Ciclos térmicos
Problema 1
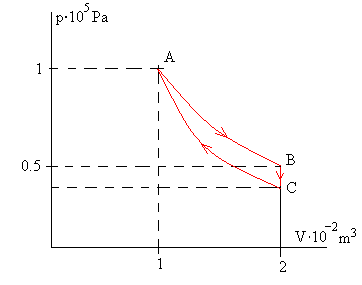
1.-Consideremos helio (gas perfecto monoatómico cv=3R/2) en el estado inicial A: pA=105 Pa, VA=10-2 m3 y TA=300 K. Se llevan a cabo las siguientes transformaciones:
A-B: Transformación isoterma reversible siendo VB=2 10-2 m3
B-C: Transformación isócora (V=cte) reversible siendo TC=189 K
C-A: Transformación adiabática reversible, que devuelve al gas a sus condiciones iniciales.
a) Determinar el número de moles de helio, confeccionar una tabla en la que aparezcan los valores p, V y T en los tres estados A, B y C, y dibujar el ciclo en el diagrama p-V.
b) Calcular, en unidades del sistema internacional, de forma directa (siempre que sea posible) el trabajo W, el calor Q, y la variación de energía interna ΔU, del gas para cada uno de los procesos.
c) Determinar el rendimiento de este ciclo como motor térmico
Dato: R=8.314 J/(mol·K)
 Solución
Solución
Vértice A: pAVA=nRTA
Transformación isoterma: pAVA= pBVB, pB=0.5·105 Pa
Transformación isócora: VB=VC.
Vértice C: pCVC=nRTC, pC=0.315·105 Pa
| Vértice | p (Pa) | V (m3) | T (K) |
| A | 105 | 10-2 | 300 |
| B | 0.5·105 | 2·10-2 | 300 |
| C | 0.315·105 | 2·10-2 | 189 |
Índice adiabático
- A→B, proceso isotermo
- B→C, proceso isócoro
- C→A, proceso adiabático
ΔUAB=0
WBC=0
QBC= ΔUBC=-555 J
QCA=0
WCA=- ΔUCA=-555 J
Calculo del trabajo de forma directa
Ecuación de una adiabática
Ciclo completo
| Proceso | ΔU (J) | Q (J) | W(J) |
| A→B | 0 | 693 | 693 |
| B→C | -555 | -555 | 0 |
| C→A | 555 | 0 | -555 |
| Total | 0 | 138 |
- Calor absorbido, Qabs=693 J
- Calor cedido, Qced=-555
- Trabajo realizado, W=138 J
Se cumple que, Qabs+Qced≈W
Rendimiento
Problema 2
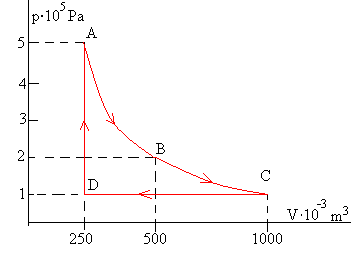
Diez moles de un gas diatómico (cv=5R/2) se encuentran inicialmente a una presión de pA = 5·105 Pa y ocupando un volumen de VA = 249·10-3 m3. Se expande adiabáticamente (proceso AB) hasta ocupar un volumen VB = 479·10-3 m3. A continuación el gas experimenta una transformación isoterma (proceso BC) hasta una presión pC = 105 Pa. Posteriormente se comprime isobáricamente (proceso CD) hasta un volumen VD = VA = 249·10-3 m3. Por último, experimenta una transformación a volumen constante (proceso DA) que le devuelve al estado inicial.
- Representar gráficamente este ciclo en un diagrama p-V.
- Calcular el valor de las variables termodinámicas desconocidas en los vértices A, B, C y D.
- Hallar el calor, el trabajo, la variación de energía interna, en Joules, de forma directa y/o empleando el Primer Principio, en cada etapa del ciclo.
- Calcular el rendimiento.
R= 0.082 atm·l/(mol·K) = 8.314 J/(mol·K) ; 1 cal = 4.186 J; 1 atm = 1.013 105 Pa
 Solución
Solución
Índice adiabático
Vértice A. pA·VA=nRTA, TA=1497.5 K
A→B,
proceso adiabático.
Vértice B. pB·VB=nRTB, TB=1152.7 K
B→C, proceso isotérmico. . pB·VB= pC·VC , VC =958.3·10-3 m3
Vértice D. pD·VD=nRTD, TD=299. 5 K
| Vértice | p (Pa) | V (m3) | T (K) |
| A | 5·105 | 249·10-3 | 1497.5 |
| B | 2·105 | 479·10-3 | 1152.7 |
| C | 1·105 | 958.3·10-3 | 1152.7 |
| D | 1·105 | 249·10-3 | 299.5 |
- A→B, proceso adiabático
- B→C, proceso isotermo
- C→D, proceso isóbaro
- D→A, proceso isócoro
QAB=0
WAB=- ΔUAB=-71 667 J
Calculo del trabajo de forma directa
Como vemos, WAB≈- ΔUAB
ΔUBC=0
Comprobación, ΔU≈Q-W
WDA=0
QDA= ΔUDA= 249 004 J
Ciclo completo
| Proceso | ΔU (J) | Q (J) | W(J) |
| A→B | -71 667 | 0 | 71 667 |
| B→C | 0 | 66 458 | 66 458 |
| C→D | -177 338 | -248 273 | -70 930 |
| D→A | 249 004 | 249 004 | 0 |
| Total | 0 | 67 278 |
- Calor absorbido, Qabs=315 462 J
- Calor cedido, Qced=-248 273
- Trabajo realizado, W=67 278 J
Se cumple que, Qabs+Qced≈W
Rendimiento
Problema 3
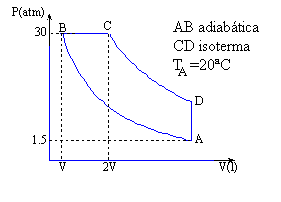 Una máquina
térmica trabaja con 3 moles de un gas monoatómico, describiendo el ciclo
reversible ABCD de la figura. Sabiendo que VC = 2 VB:
Una máquina
térmica trabaja con 3 moles de un gas monoatómico, describiendo el ciclo
reversible ABCD de la figura. Sabiendo que VC = 2 VB:
- Calcular el valor de las variables termodinámicas desconocidas en cada vértice.
- Deducir las expresiones del trabajo en cada etapa del ciclo.
- Calcular de forma directa en cada etapa del ciclo (siempre que sea posible), el trabajo, el calor, la variación de energía interna y la variación de entropía
- El rendimiento del ciclo.
R=0.082 atm·l/(mol·K) = J/(mol·K); 1cal=4.186 J; 1atm=1.013·105Pa, cv=3R/2
 Solución
Solución
Índice adiabático
Vértice A. pA·VA=nRTA, 1.5·VA=3·0.082·293, VA=48.05 l
A→B, proceso adiabático.
Vértice B. pB·VB=nRTB, TB=971.1 K
Vértice C. pB·2VB=nRTC, TC=1942.3 K
C→D, proceso isotérmico. . pC·VC= pD·VD , pD =9.95 atm
| Vértice | p (atm) | V (l) | T (K) |
| A | 1.5 | 48.05 | 293 |
| B | 30 | 7.96 | 971.1 |
| C | 30 | 15.93 | 1942.3 |
| D | 9.95 | 48.05 | 1942.3 |
- A→B, proceso adiabático
- B→C, proceso isóbaro
- C→D, proceso isotermo
- D→A, proceso isócoro
QAB=0
WAB=- ΔUAB=--250.2 atm·l
Calculo del trabajo de forma directa
Como vemos, WAB≈- ΔUAB
ΔSAB=0
Comprobación, ΔU≈Q-W
ΔUCD=0
Ciclo completo
| Proceso | ΔU (atm·l) | Q (atm·l) | W(atm·l) | ΔS (atm·l/K) |
| A→B | 250.2 | 0 | -250.2 | 0 |
| B→C | 358.4 | 597.3 | 239.1 | 0.43 |
| C→D | 0 | 527.5 | 527.5 | 0.27 |
| D→A | -608.6 | -608.6 | 0 | -0.70 |
| Total | 0 | 516.4 | 0 |
- Calor absorbido, Qabs=1124.8 atm·l
- Calor cedido, Qced=-608.6 atm·l
- Trabajo realizado, W=516.4 atm·l
Se cumple que, Qabs+Qced≈W
Rendimiento
Problema 4
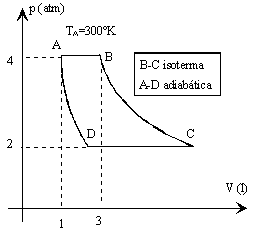 El ciclo de la figura que describe un gas ideal monoatómico
El ciclo de la figura que describe un gas ideal monoatómico
- Calcular el valor de las variables termodinámicas desconocidas en los vértices A, B y C.
- Hallar de forma directa el trabajo en cada etapa.
- El calor, la variación de energía interna y la variación de entropía en cada etapa del ciclo. (Expresar los resultados en Joules).
- Hallar el rendimiento del ciclo.
R=0.082 atm·l/(K·mol) 1 cal= 4.186 J. 1 atm = 1.013·105 Pa
 Solución
Solución
Índice adiabático
Vértice A. pA·VA=nRTA, nR=4/300=1/75
D→A, proceso adiabático.
Vértice B. pB·VB=nRTB, TB=900 K
Vértice C. pC·VC=nRTB, VC=6 l
C→D, proceso isotérmico. . pC·VC= pD·VD , pD =9.95 atm
| Vértice | p (atm) | V (l) | T (K) |
| A | 4 | 1 | 300 |
| B | 4 | 3 | 900 |
| C | 2 | 6 | 900 |
| D | 2 | 1.52 | 227.3 |
- A→B, proceso isóbaro
- B→C, proceso isotermo
- C→D, proceso isóbaro
- D→A, proceso adiabático
Comprobación, ΔU≈Q-W
ΔUBC=0
Comprobación, ΔU≈Q-W
QDA=0
WDA=-ΔUDA=1.45 atm·l
Calculo del trabajo de forma directa
Como vemos, WDA≈- ΔUDA
ΔSDA=0
Factor de conversión. 1 atm·l=1.013·105·10-3=101.3 J
Ciclo completo
| Proceso | ΔU (J) | Q (J) | W(J) | ΔS(J/K) |
| A→B | 1216 | 2026 | 810 | 3.71 |
| B→C | 0 | 843 | 843 | 0.94 |
| C→D | -1362 | -2269 | -908 | -4.65 |
| D→A | 147 | 0 | -147 | 0 |
| Total | 0 | 598 | 0 |
- Calor absorbido, Qabs=2869 J
- Calor cedido, Qced=-2269 J
- Trabajo realizado, W=598 J
Se cumple que, Qabs+Qced≈W
Rendimiento
