Medida del calor latente de fusión
Se introduce una masa m de hielo a un
calorímetro con agua a una temperatura T ligeramente por encima de
la temperatura ambiente Ta y se agita la mezcla hasta
que el hielo se funde completamente. Se elige la masa m del hielo
de modo que la temperatura Te de equilibrio esté
ligeramente por debajo de la temperatura ambiente, es decir, de modo que T-Ta≈T-Te.
De este modo, el calor cedido al ambiente en la primera etapa de la
experiencia se compensa con el calor ganado en la segunda etapa.
En la experiencia que se describe a continuación, se emplea el procedimiento de las mezclas pero no se tiene en cuenta las pérdidas o ganancias de calor entre el calorímetro y el medio ambiente.
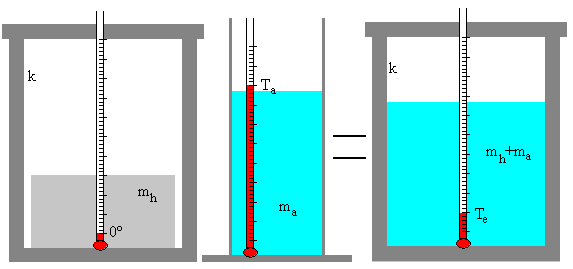
Una masa ma de agua a la temperatura inicial Ta se mezcla con una masa mh de hielo a 0º C en un calorímetro. La mezcla de agua y hielo se agita hasta que se alcanza una temperatura final de equilibrio Te.
Pueden ocurrir dos casos
-
Se funde una parte m de la masa inicial mh de hielo, quedando una mezcla formada por hielo (mh-m) y agua (ma+m) a la temperatura final de Te=0ºC.
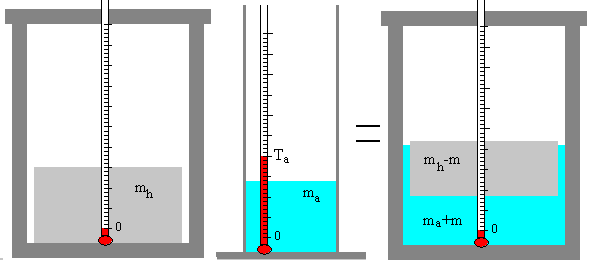
- El calor absorbido por el hielo es Q1=m·Lf
- El calor cedido por el agua es Q2=ma·c·(0-Ta)
Si el calorímetro está perfectamente aislado, no pierde ni gana calor, se cumplirá que
(1)
-
Si se funde todo el hielo, el estado final es una masa (mh+ma) de agua a la temperatura final Te>0.
Ahora hemos que tener en cuenta que la masa mh de hielo se convierte en agua y a continuación, eleva su temperatura de 0ºC a Te. Por otra parte, el calorímetro (su masa equivalente en agua k) eleva su temperatura de 0º C a Te.
- El calor absorbido por el hielo es Q1=mh·Lf+ mh·c·(Te-0)
- Calor absorbido por el calorímetro Q2= k·c·(Te-0)
- El calor cedido por el agua es Q3=ma·c·(Te-Ta)
Si el calorímetro está perfectamente aislado, no pierde ni gana calor, se cumplirá que
(2)
En la página “calor específico de un sólido”, ya se ha explicado el significado de masa equivalente k en agua del calorímetro.
Actividades
- Medida del equivalente en agua del calorímetro
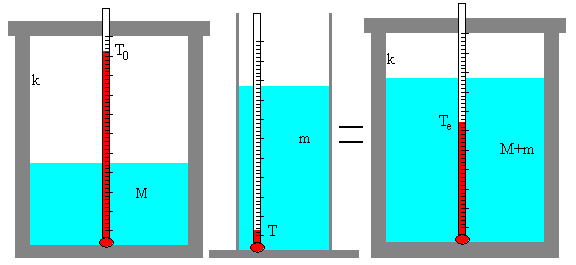
Introducimos los siguientes datos:
- Masa M de agua en gramos en el calorímetro,
- Temperatura T0 inicial del calorímetro
- Masa m de agua en gramos en una probeta
- Temperatura T del agua
Se pulsa el botón titulado Preparar, los termómetros y las escalas graduadas de medida del volumen de agua reflejan los datos introducidos.
Si estamos conformes, se pulsa el botón titulado Calcular. La masa m de agua se vierte en el calorímetro y en el termómetro podemos leer la temperatura final de equilibrio Te.
Ejemplo:
- Sea M=170 g, T0=92.7 ºC
- Sea m=170 g, y T=2.7 ºC
- La temperatura de equilibrio es Te=54.2ºC
El equivalente en agua del calorímetro será
- Medida del calor de fusión
Introducimos los siguientes datos:
- Masa mh de hielo en gramos en el calorímetro,
- Temperatura inicial del hielo se fija en 0ºC
- Masa ma del agua en gramos
- Temperatura Ta del agua
Se pulsa el botón titulado Preparar.
Si estamos conformes, se pulsa el botón titulado Calcular. El agua se vierte en el calorímetro y en el termómetro podemos leer la temperatura final de equilibrio Te.
En el caso de que solamente una parte del hielo se fundiese, la temperatura final sería Te=0ºC. Se podría extraer el hielo del calorímetro, y pesarlo en una balanza. Conocida la masa m de hielo se determinaría el calor de fusión mediante la fórmula (1). Cuando se produzca esta situación, se incrementa la masa de agua o su temperatura o ambas cosas a la vez, hasta conseguir que todo el hielo del calorímetro se funda.
Ejemplo:
- Hielo: mh=128 g,
- Agua, ma=170 g, y Ta=80ºC
- Se funde todo el hielo y la temperatura final de equilibrio es Te=9.5 ºC
- La masa equivalente en agua del calorímetro la hemos calculada en el apartado anterior k=57.4 g
Referencias
Güemez, Fiolhais C., Fiolhais M. Revisiting Black's experiments on the latent heats of water. The Physics Teacher Vol 40, January 2002, pp. 26-31