El ciclo de Carnot
 |
 |
Motores de combustión interna. Laboratorio de Física. E.U. Ingeniería Técnica de Minas y Obras Públicas (Barakaldo)
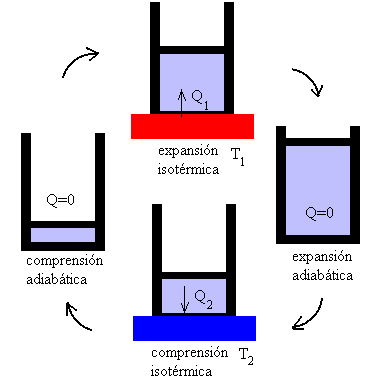
Se define ciclo de Carnot como un proceso cíclico reversible que utiliza un gas perfecto, y que consta de dos transformaciones isotérmicas y dos adiabáticas, tal como se muestra en la figura.
La representación gráfica del ciclo de Carnot en un diagrama p-V es el siguiente
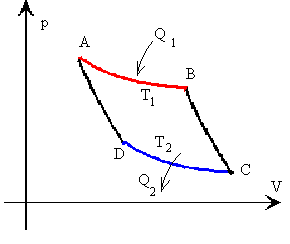 |
Tramo A-B isoterma a la temperatura T1
Tramo B-C adiabática Tramo C-D isoterma a la temperatura T2 Tramo D-A adiabática |
En cualquier ciclo, tenemos que obtener a partir de los datos iniciales:
- La presión, volumen de cada uno de los vértices.
- El trabajo, el calor y la variación de energía interna en cada una de los procesos.
- El trabajo total, el calor absorbido, el calor cedido, y el rendimiento del ciclo.
Los datos iniciales son los que figuran en la tabla adjunta. A partir de estos datos, hemos de rellenar los huecos de la tabla.
| Variables | A | B | C | D |
| Presión p (atm) | pA | |||
| Volumen V (litros) | VA | VB | ||
| Temperatura T (K) | T1 | T1 | T2 | T2 |
Las etapas del ciclo
Para obtener las variables y magnitudes desconocidas emplearemos las fórmulas que figuran en el cuadro-resumen de las transformaciones termodinámicas.
- Transformación A->B (isoterma)
- Transformación B->C (adiabática)
- Transformación C->D (isoterma)
- Transformación D-> A (adiabática)
La presión pB se calcula a partir de la ecuación del gas ideal
Variación de energía interna
Trabajo
Calor
La ecuación de estado adiabática es o bien, . Se despeja Vc de la ecuación de la adiabática . Conocido Vc y T2 se obtiene pc, a partir de la ecuación del gas ideal. .
Calor
Variación de energía interna
Trabajo
Variación de energía interna
Trabajo
Calor
Se despeja VD de la ecuación de la adiabática . Conocido VD y T2 se obtiene pD, a partir de la ecuación del gas ideal. .
Calor
Variación de energía interna
Trabajo
A partir de las ecuaciones de las dos adiabáticas, podemos probar que la relación entre los volúmenes de los vértices es
,
El ciclo completo
- Variación de energía interna
En un proceso cíclico reversible la variación de energía interna es cero
- Trabajo
Los trabajos en las transformaciones adiabáticas son iguales y opuestos.
- Calor
En la isoterma T1 se absorbe calor Q>0 ya que VB>VA de modo que
En la isoterma T2 se cede calor Q<0 ya que VD<VC
- Rendimiento del ciclo
Se define rendimiento como el cociente entre el trabajo realizado y el calor absorbido
Ejemplo
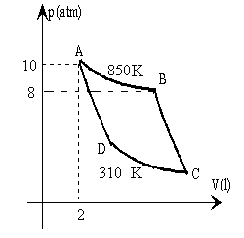 Un gas diatómico, cv=5R/2, describe el ciclo de Carnot de la figura. Las transformaciones A-B y C-D son isotermas y las transformaciones B-C y D-A son adiabáticas.
Un gas diatómico, cv=5R/2, describe el ciclo de Carnot de la figura. Las transformaciones A-B y C-D son isotermas y las transformaciones B-C y D-A son adiabáticas.
- Hallar los valores de la presión, el volumen, y la temperatura de cada uno de los vértices A, B, C y D a partir de los datos suministrados en la figura.
- Calcular de forma explícita el trabajo en cada una de las transformaciones, la variación de energía interna, y el calor.
- Hallar el rendimiento del ciclo, y comprobar que coincide con el valor dado por la fórmula del rendimiento de un ciclo de Carnot.
Dato: R=8.314 J/(K mol)=0.082 atm.l/(K mol)
- Presión y volumen de los cuatro vértices
| Vértice | p(atm) | V(l) | T(K) |
| A | 10 | 2 | 850 |
| B | 8 | 2.5 | 850 |
| C | 0.23 | 31.12 | 310 |
| D | 0.29 | 24.90 | 310 |
- Trabajo, calor y variación de energía interna en los cuatro procesos
| Proceso | W(atm·l) | Q(atm·l) | ΔU(atm·l) |
| A→B | 4.46 | 4.46 | 0 |
| B→C | 31.76 | 0 | -31.76 |
| C→D | -1.62 | -1.62 | 0 |
| D→A | -31.76 | 0 | 31.76 |
| Ciclo | 2.84 | 0 |
- Ciclo completo
Trabajo total: W=2.84 atm·l
Calor absorbido: Qabs=4.46 atm·l
Calor cedido: Qced=1.62 atm·l
Rendimiento
Motor y frigorífico
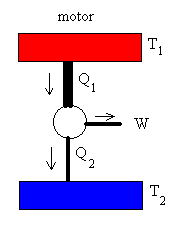 |
Un motor de Carnot es un dispositivo ideal que describe un ciclo de
Carnot. Trabaja entre dos focos, tomando calor Q1 del foco caliente a
la temperatura T1, produciendo un trabajo W, y cediendo un
calor Q2 al foco frío a la temperatura T2.
En un motor real, el foco caliente está representado por la caldera de vapor que suministra el calor, el sistema cilindro-émbolo produce el trabajo y se cede calor al foco frío que es la atmósfera. |
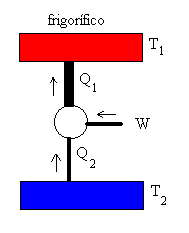 |
La máquina de Carnot también puede funcionar en sentido inverso,
denominándose entonces frigorífico. Se extraería calor Q2 del foco
frío aplicando un trabajo W, y cedería Q1 al foco caliente.
En un frigorífico real, el motor conectado a la red eléctrica produce un trabajo que se emplea en extraer un calor del foco frío (la cavidad del frigorífico) y se cede calor al foco caliente, que es la atmósfera. |
Actividades
Introducir los valores de las siguientes variables
- Temperatura del foco caliente T1
- Temperatura del foco frío T2
Se tiene que cumplir que T1> T2
- El volumen de A, VA,
- El volumen de B, VB.
Se tiene que cumplir que VA< VB
- La presión de A, pA
Si no se cumplen las condiciones anteriores un mensaje nos lo señala en el borde inferior del applet.
Una vez introducidos los datos se pulsa el botón titulado Empieza, el programa interactivo calcula:
- La presión y el volumen de cada uno de los vértices
- El trabajo, calor y variación de energía interna en cada una de las transformaciones
- El trabajo total , el calor absorbido y el calor cedido.
