Variaciones de entropía en procesos irreversibles
Para calcular las variaciones de entropía de un proceso real (irreversible) hemos de recordar que la entropía (como la energía interna) depende solamente del estado del sistema. Una variación de entropía cuando el sistema pasa de un estado A a otro B de equilibrio depende solamente del estado inicial A y del estado final B.
Para calcular la variación de entropía ΔS de un proceso irreversible entre dos estados de equilibrio, imaginamos un proceso reversible entre el estado inicial A y el estado final B y calculamos para este proceso
Como veremos en los ejemplo, la variación de entropía ΔS es siempre positiva para el sistema y sus alrededores en un proceso irreversible.
La entropía de un sistema aislado que experimenta un cambio siempre se incrementa. En un proceso reversible la entropía del sistema aislado permanece constante.
Conducción térmica

En el proceso de conducción del calor, el sistema está formado por un foco caliente a la temperatura Ta conectado mediante una barra a un foco frío a la temperatura Tb. La barra hecha de un material conductor del calor está perfectamente aislada. Se transfiere a través de la barra una cantidad de calor Q del foco caliente al foco frío. Como el foco frío absorbe calor, su entropía aumenta en Q/Tb. Al mismo tiempo, como el foco caliente pierde calor su variación de entropía es -Q/Ta
Como Ta>Tb, la variación de entropía del sistema formado por la barra y los dos focos es positivo
Cambio de estado
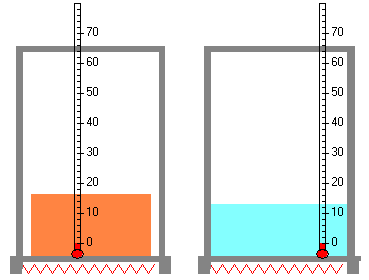
Un sólido cuyo calor de fusión es Lf funde a la temperatura Tf. Calcular la variación de entropía cuando una masa m de sólido funde.
En el proceso de cambio de estado una sustancia absorbe una cantidad de calor mLf manteniendo la temperatura constante Tf
Calorímetro de mezclas
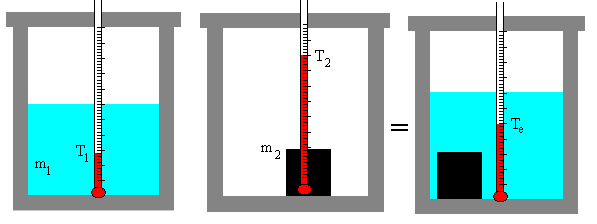
En un calorímetro de mezclas, una sustancia de masa m1 y calor específico c1 y temperatura inicial T1 se coloca en contacto con una segunda sustancia de masa m2, calor específico c2 y temperatura inicial T2>T1. Las dos sustancias se colocan en un calorímetro de modo que forman ambas un sistema aislado. Una vez que alcanzan el equilibrio térmico a la temperatura Te vamos a calcular la variación de entropía.
La sustancia que inicialmente tiene la temperatura mas alta cede calor a la sustancia que inicialmente tiene temperatura más baja, la primera disminuye su temperatura, la segunda la aumenta hasta que ambas alcanzan el equilibrio a la temperatura Te.
m1·c1·(Te-T1)+m2·c2·(Te-T2)=0
El proceso es irreversible por que el sistema evoluciona desde el estado inicial al final a través de una serie de estado de no equilibrio.
Para calcular la variación de entropía, podemos imaginar que la sustancia que tiene la temperatura más alta T1 se enfría hasta una temperatura Te poniéndola en contacto sucesivamente con focos de calor que difieren infinitesimalmente en temperatura, el primer foco tiene una temperatura T2 y el último Te. Podemos imaginar un proceso similar para la sustancia inicialmente a menor temperatura T2.
El calor absorbido o cedido en un cambio infinitesimal de temperatura es
dQ=mcdT
Como Te>T1 el primer término es positivo, y como Te<T2 el segundo término es negativo, el resultado final es que ΔS>0
Expansión de un gas
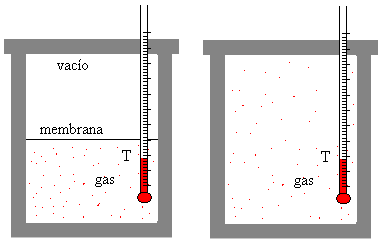
Consideremos la expansión adiabática de un gas ideal que ocupa inicialmente un volumen V1. Se rompe la membrana que separa el gas de la región en la que se ha hecho el vacío, el gas se expande irreversiblemente hasta ocupar un volumen V2.
El trabajo realizado por el gas es cero W=0, y ya que las paredes del recipiente son aislantes, no se transfiere energía hacia el exterior, Q=0
Como la energía interna no cambia ΔU=0, la temperatura no cambia, ya que la energía interna de un gas ideal solamente depende de la temperatura T.
Para calcular la variación de entropía, podemos imaginar un proceso reversible isotérmico a la temperatura T en la que el gas empuje muy despacio el émbolo mientras la energía entra en el gas procedente de un foco de calor para mantener la temperatura constante.
En un proceso isotérmico, no hay variación de energía interna, el primer principio implica que el calor absorbido es igual al trabajo realizado por el gas durante su expansión de V1 a V2.
dQ=dW=pdV
Como V2>V1 se concluye que ΔS>0
