Medida de la viscosidad de un gas mediante un tubo capilar
La ley de Poiseuille para los gases
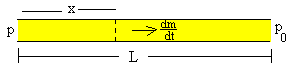
Supongamos un tubo capilar de radio r y longitud L por el cual fluye un gas cuando la diferencia de presión en sus extremos es p-p0
La ley de Poiseuille que hemos deducido para un fluido viscoso incomprensible, afirma que el gasto G=dV/dt (volumen de fluido que atraviesa la sección normal del capilar en la unidad de tiempo) es directamente proporcional al gradiente de presión a lo largo del tubo, es decir al cociente (p-p0)/L.
Ahora bien, para un gas que fluye a través del tubo capilar, el volumen de gas que entra en la unidad de tiempo a una presión p no es igual al volumen que sale del tubo a la presión p0 (atmosférica) debido a la comprensibilidad de los gases. Sin embargo, la masa de gas que entra en la unidad de tiempo es igual a la masa de gas que sale en la unidad de tiempo.
Escribimos la ley de Poiseuille de la forma
dV/dt es el volumen de gas que atraviesa la sección normal del tubo capilar situada a una distancia x del extremo del tubo, en la unidad de tiempo. dp/dx es el gradiente de presión en dicha posición.
Teniendo en cuenta la ley de los gases ideales p·V=nRT
-
n es el número de moles n=m/M ,
-
m es la masa de gas contenida en el volumen V,
-
M el peso molecular,
-
R=8.3143 J/(K·mol) la constante de los gases
-
T la temperatura absoluta.
La ley de Poiseuille se escribe
El signo menos aparece por que la presión p del gas disminuye a medida que sale por el tubo capilar
Integramos esta ecuación teniendo en cuenta que dm/dt es constante a lo largo del tubo capilar. La presión en el extremo x=0 del tubo capilar es p y la presión en el otro extremo x=L es p0 (atmosférica).
El dispositivo experimental
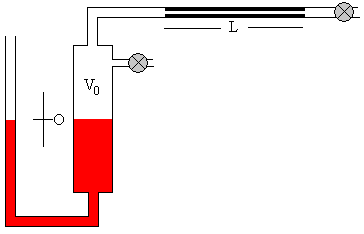
En la figura, se muestra la situación inicial del dispositivo. El manómetro de mercurio a la izquierda, el volumen V0 de la región comprendida entre el mercurio y el tubo capilar, el tubo capilar de longitud L y radio r.
El gas cuya viscosidad se va a medir, se introduce en la región comprendida entre el mercurio del manómetro y el capilar, hasta alcanzar la presión p deseada.
 |
|
Cuando se alcanza la presión deseada, se abre la llave situada en el extremo del capilar, el gas fluye a través del mismo impulsado por la diferencia de presión p-p0, la diferencia de alturas 2h de los niveles de mercurio en las dos ramas del manómetro va disminuyendo.
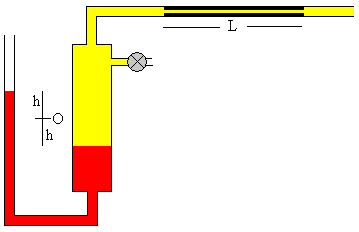
En el instante t la diferencia de alturas de los niveles de mercurio en las dos ramas del manómetro es 2h.
La presión p y el volumen V del gas contenido en el recipiente, va cambiando con el tiempo. La masa m de gas contenido en el recipiente, disminuye. La masa que atraviesa la sección normal del capilar en la unidad de tiempo es, aplicando la ley de los gases ideales
Aplicando la ley de Poiseuille al movimiento de un gas a través de un capilar
Para integrar expresamos el volumen V del gas y su presión p en función de la variable h.
p=p0+2ρgh dp=2ρg·dh
V=V0+S·h dV=S·dh
p0= ρgH, es la presión atmosférica. H=76 cm altura de la columna de mercurio
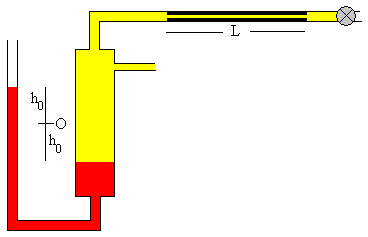
La diferencia ente los niveles de mercurio en las dos ramas del manómetro es 2h0 en el instante t=0. Al cabo de un cierto tiempo t, ha salido una cierta cantidad de gas por el tubo-capilar y la presión ha disminuido, la diferencia entre los niveles de mercurio en las dos ramas del manómetro es 2h.
Manteniendo fijos h0 y h en las medidas que se realizan con los gases disponibles, vemos que el tiempo t es proporcional a la viscosidad η, la constante de proporcionalidad K se denomina constante del aparato. Se determina, habitualmente, a partir del dato de la viscosidad conocida de un gas (por ejemplo, el aire).
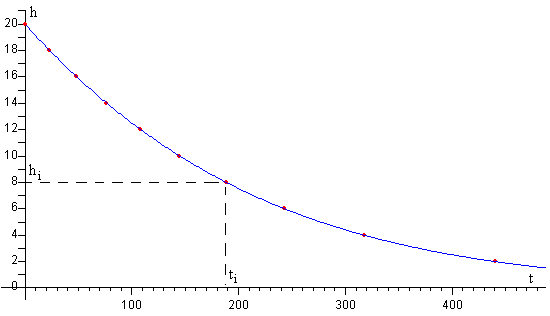
Como la diferencia de alturas 2h ente los niveles de mercurio en las dos ramas del manómetro, es una función implícita del tiempo t. En la simulación, se calcula el tiempo ti que corresponde a n valores de la altura hi comprendidas entre h0 y 0 (excluido h=0). A partir de estos pares de datos, se calcula una función de interpolación para cualquier valor de t empleando el procedimiento denominado polinomio de Lagrange, tal como se aprecia en la figura.
Actividades
-
Se selecciona el gas, en el control de selección titulado Gas
Los datos que se ha fijado en el programa interactivo (tomadas parcialmente del segundo artículo citado en las referencias) son los siguientes:
-
Densidad del mercurio, ρ=13.55 g/cm3
-
Longitud del capilar, L=85.0 cm
-
Radio del capilar, r=0.127 mm
-
Área de la sección del manómetro, S=3.89 cm2
-
Volumen inicial cuando se introduce el gas, V0=81.65 cm3
-
La presión atmosférica equivale a la presión de una columna de mercurio de H=76 cm de altura.
Se pulsa el botón titulado Inicio
Se cierra la llave situada en el extremo del tubo capilar.
Se abre la llave de admisión del gas y la región comprendida entre el mercurio y el tubo capilar se va llenando de gas. La presión y el volumen del gas aumentan. Cuando el manómetro marca una altura h0,
-
La presión inicial del gas es p=p0+2ρgh0
-
El volumen inicial del gas es V=V0+S·h0
Se pulsa el botón titulado Empieza
Se cierra la llave de admisión del gas y se abre la llave en el extremo del tubo capilar, de modo que el gas empieza a salir. La presión y el volumen del gas disminuyen, cuando el nivel del mercurio en el manómetro señala una altura h se pulsa el botón titulado Pausa
Se anota h y el tiempo t. Se calcula la viscosidad η del gas.
Ejemplo
-
Se elige Hidrógeno
-
Se introduce el gas a la máxima presión. El manómetro marca h0=20 cm
-
Se deja salir el gas a través del tubo capilar
-
Cuando el manómetro marca h=10 cm, ha transcurrido un tiempo t=145.0 s
η=8.84·10-6 kg/(m·s)
Pulsando el botón titulado Respuesta obtenemos el valor η=8.85·10-6 kg/(m·s) próximo al calculado.
Referencias
Nienart L., Measuring the viscosity of gases. Am. J. Phys. 62 (6) June 1994, pp. 566-568
Cronin D. J., Temperature and pressure dependence of viscosity of gases. Am. J. Phys. 33 (1965) pp. 835-840
