Modelo cinético de gas ideal
Una vez que se suelta el émbolo situado en la posición x0, describe varias oscilaciones hasta que alcanza una posición de equilibrio final en el que las presiones a ambos lados del émbolo se igualan. Para determinar los volúmenes finales o las temperaturas finales necesitamos formular un modelo de gas ideal que nos describa la evolución desde el estado inicial al estado final de equilibrio.
El número de moléculas cuya velocidad está comprendida entre v y v+dv, es decir, entre vx y vx+dvx, vy y vy+dvy, vz y vz+dvz, de acuerdo a la ley de Boltzmann es
donde dv es un elemento de volumen en el espacio de las velocidades.
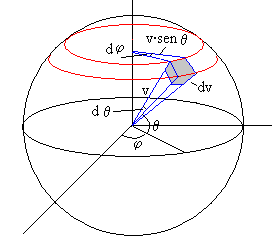 Expresamos el elemento de volumen dv en el espacio de velocidades en coordenadas polares. Para ello,
Expresamos el elemento de volumen dv en el espacio de velocidades en coordenadas polares. Para ello,
-
Trazamos dos esferas concéntricas de radio v y v+dv.
-
Cortamos las esferas por dos planos meridianos que pasan por los ángulos φ y φ+dφ.
-
Cortamos las esferas por dos planos paralelos de ángulos θ, y θ+dθ
El volumen comprendido es paralepípedo elemental de color gris de la figura tiene por lados
dv
v·sinθ·dφ
v·dθ
Su volumen es
dv=v2·sinθ·dv·dθ·dφ
Número de moléculas del gas que chocan con el émbolo
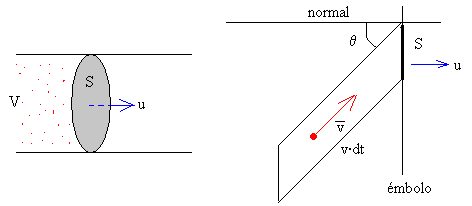
El número de moléculas con velocidad v que chocan contra una porción de émbolo de área S en el tiempo dt, que se mueven en una dirección que hace un ángulo θ con la normal a la pared, son las contenidas en el volumen cilíndrico de base S y altura v·cosθ·dt. Se multiplica el número de moléculas por unidad de volumen (dn/V) por el volumen del cilindro de la figura de la derecha.
(dn/V)·S·v·cosθ·dt.
Ahora bien, el émbolo no está en reposo, sino que se mueve con velocidad u a lo largo de la dirección normal a S. La componente de la velocidad de las moléculas con relación al émbolo es v·cosθ-u. Donde u es positiva cuando el gas incrementa su volumen y negativa cuando lo disminuye. Se supone que u es pequeña comparada con las velocidades moleculares v.
El número de moléculas del gas que chocan con el émbolo en el intervalo de tiempo comprendido entre t y t+dt es
donde dV=S·u·dt es el incremento del volumen del gas
Choque elástico de una molécula con el émbolo
Una partícula de masa m y velocidad vx choca elásticamente con un émbolo de masa M que se mueve con velocidad u.
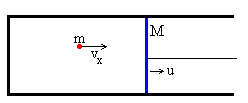
Aplicamos la conservación del momento lineal y la igualdad de la energía cinética antes y después del choque
Escribimos las dos ecuaciones en la forma equivalente
Despejando las incógnitas
Como la masa M del émbolo es muy grande comparado con masa m de la partícula
Una deducción alternativa es la siguiente:
La partícula choca con el émbolo y cambia el sentido de su velocidad en el Sistema de Referencia del émbolo, la velocidad de la partícula
-
Antes del choque es (vcosθ-u)
-
Después del choque es -(vcosθ-u)
En el Sistema de Referencia del Laboratorio, las velocidades de la partícula
-
Antes del choque es (vcosθ-u)+u= vcosθ
-
Después del choque es -(vcosθ-u)+u=2u-vcosθ
Variación de la energía interna del gas ideal
El cambio de energía cinética de la partícula es
Las moléculas cuando chocan con el émbolo ganan o pierden energía cinética. Si ganan energía cinética, la energía interna del gas aumenta y también lo hace la temperatura y si pierden, la energía interna del gas disminuye.
Vamos a calcular el cambio de energía interna debido a todos los choques de las moléculas del gas con el émbolo móvil en el intervalo de tiempo comprendido entre t y t+dt o bien, cuando el volumen del gas cambia de V a V+dV.
Para calcular la integral triple, establecemos los límites de integración para la variable v, φ y θ.
Los límites de la primera integral respecto de φ, son 0 y 2π, se integra para todos los ángulos, pero solamente se integra para ángulos θ comprendidos entre 0 y π/2, ya que cuando θ>π/2, v·cosθ se hace negativa y la partícula se aleja de la pared. Por último, se integra para todas las velocidades, desde 0 a ∞.
Empleando los resultados de las integrales
Llegamos a la siguiente expresión
Definimos nuevas variables:
-
Mg=mN es la masa del gas (m es la masa de una molécula y N es el número de moléculas contenidas en el volumen V del gas). Para un mol de gas, N es el número de Avogadro, N·k=R=8.3143 J/(K·mol)
-
u=dx/dt es la velocidad del émbolo (x es la posición del émbolo)
-
V=S·x es el volumen del gas
-
El cambio infinitesimal de volumen del gas es dV=S·dx=S·(dx/dt)dt
-
dU=cv·dT, es la variación de energía interna de un mol de gas ideal. cv es el calor específico molar a volumen constante.
Aproximación al equilibrio
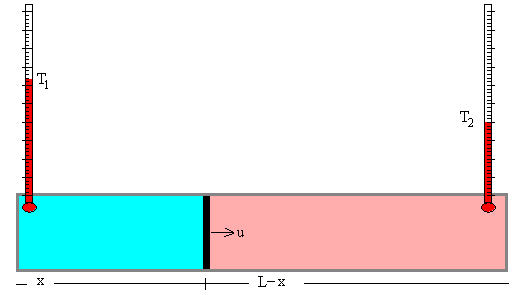
Ahora volvemos al estudio del sistema formado por los dos gases separados por un émbolo móvil
-
T1 es la temperatura del gas situado a la izquierda del émbolo
-
T2 es la temperatura del gas situado a la derecha del émbolo,
-
x la posición del émbolo,
-
S·x es el volumen del gas contenido en la parte izquierda
-
S·(L-x) el volumen del gas de la parte derecha del émbolo.
-
Suponemos que el gas de la parte izquierda incrementa su volumen (dx/dt)>0, el gas de la parte derecha disminuye el volumen (dx/dt)<0
Variación de la temperatura
La ecuación para la variación de la temperatura T1 del gas situado en la parte izquierda es
La ecuación para la variación de la temperatura T2 del gas situado en la parte derecha es
Aproximación:
Si despreciamos los términos en (dx/dt)2 y (dx/dt)3 llegamos a la ecuación
que integrada nos da T1·xγ-1=cte
De modo similar, obtenemos T2(L-x)γ-1=cte
Recuérdese que cp=cv+R y γ=cp/cv
Ecuación del movimiento del émbolo
Como el sistema es aislado, la energía total permanece constante
El primer término es la energía cinética del émbolo de masa M. El segundo, la energía interna de un mol de gas contenido en la parte izquierda y el tercero, la energía interna de un mol de gas contenido en la parte derecha.
Derivamos con respecto del tiempo
Despejamos la aceleración d2x/dt2
Aproximación
Si despreciamos los términos en (dx/dt)2 y (dx/dt)3 el émbolo describe un movimiento periódico.
que estudiamos en el primer apartado, oscilaciones del émbolo
En el caso general, se resuelve el sistema de dos ecuaciones diferenciales de primer orden y una ecuación de segundo orden con las condiciones iniciales siguientes: en el instante t=0,
-
La posición del émbolo es x0, su velocidad inicial es cero dx/dt=0
-
La temperatura inicial del gas situado en la parte izquierda es T10
-
La temperatura inicial del gas situado en la parte derecha es T20
En el estado final de equilibrio dx/dt=0, y d2x/dt2=0
que corresponde a la igualdad de presiones p1f=p2f=pf a un lado y otro del émbolo, tal como hemos visto en la introducción
Escalas
Antes de resolver numéricamente el sistema de tres ecuaciones diferenciales, es conveniente escribirlas en términos de las siguientes variables adimensionales
Las ecuaciones diferenciales se convierten en
Se resuelve el sistema de ecuaciones diferencias por procedimientos numéricos, con las siguientes condiciones iniciales, en el instante τ=0, ξ=ξ0, (dξ/dτ)0=0,θ1=θ10, θ2=1-θ10
Se comprueba que se cumple la conservación de la energía expresada en términos de las variables adimensionales de la forma
En el estado final, (dξ/dτ)=0 y (d2ξ/dτ2)=0 la relación entrelas variables adimensionales serán:
-
Conservación de la energía
θ1f+θ2f=1
-
En la ecuación del movimiento del émbolo
Equivalente a la igualdad de presiones a uno y otro lado del émbolo
Concluyendo: el modelo cinético de gas ideal nos predice los valores finales de equilibrio de las temperaturas T1f, T2f y de los volúmenes V1f=S·xf, V2f=S·(L-xf), mientras que la Termodinámica solamente nos dice que las presiones de los gases se deberán de igualar.
Actividades
Se pulsa el botón titulado Inicio
Se introduce
-
La temperatura adimensional inicial θ10 del gas situado en la parte izquierda del cilindro, actuando en la barra de desplazamiento titulada Temperatura 1
-
La temperatura inicial del gas situado en la parte derecha del cilindro vale θ20=1-θ10
-
El valor del parámetro δ, en el control de edición titulado Parámetro
Se pulsa el botón titulado Empieza
Observamos las oscilaciones del émbolo, hasta que al cabo de cierto tiempo alcanza la posición de equilibrio. Cuanto mayor sea el valor del parámetro δ, antes se alcanzará dicha posición.
Los termómetros marcan en cada instante las temperaturas adimensionales θ1 y θ2
En la parte superior del applet, se representa la posición ξ del émbolo en función del tiempo adimensional τ.
En la parte superior derecha del applet, se representa un diagrama en forma de tarta:
-
en color azul, la energía interna del gas situado en la parte izquierda del cilindro, θ1
-
en color rojo, la energía interna del gas situado en la parte derecha, θ2
-
en color negro, la energía cinética del émbolo en términos de variables adimensionales
Probar los siguientes ejemplos:
θ10=0.9, ξ0=0.1,δ=0.1
θ10=0.7, ξ0=0.4,δ=0.0
θ10=0.9, ξ0=0.1,δ=0.05
Mueva el émbolo con el puntero del ratón
Referencias
Crosignani B., Di Porto P., Approach to thermal equilibrium in a system with adiabatic constraints. Am. J. Phys. 64 (5) May 1996, pp. 610-613
Bauman R. O., Cockerham III H. L. Pressure of an ideal gas on a moving piston. Am. J. Phys. 37 (7) July 1969, pp. 675-679
