La entropía en los procesos reversibles (II)
Vamos a calcular la variación de entropía de una sustancia que se calienta desde una temperatura T0 a una temperatura T1. Vamos a imaginar un proceso en que se realiza en N pasos consecutivos, poniendo la sustancia en contacto con N focos de calor a temperaturas sucesivamente crecientes comprendidas entre T0 y T1.
Proceso de un solo paso
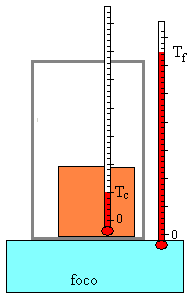 |
Colocamos un cuerpo de masa m y calor específico c cuya temperatura inicial es Tc en contacto con un foco (ambiente) cuya temperatura es Tf. |
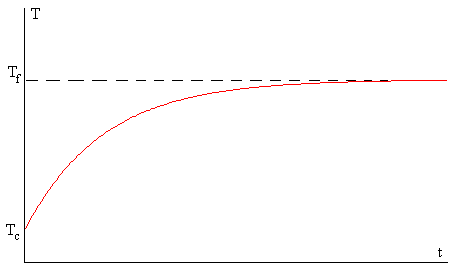
Como hemos estudiado en la página titulada “Ley del enfriamiento de Newton” al cabo de un cierto tiempo (teóricamente infinito) el cuerpo alcanza la temperatura Tf.
T=Tf+(Tc-Tf)·exp(-k·t)
El cuerpo absorbe una cantidad de calor
Q=m·c·(Tf-Tc)
La variación de entropía del cuerpo es
El foco de calor cede una cantidad de calor Q sin cambiar su temperatura Tf. Su variación de entropía es
La variación de entropía del sistema formado por el cuerpo y el foco es
ΔS= ΔSc+ΔSf>0
Proceso de N pasos
Consideremos un proceso de N pasos para calentar un cuerpo desde la temperatura T0 a la temperatura T1.
Primer paso
Colocamos un cuerpo de masa m y calor específico c cuya temperatura inicial es Tc=T0 en contacto con un foco cuya temperatura es Tf=T0+(T1-T0)/N. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Segundo paso
Colocamos el cuerpo de masa m y calor específico c cuya temperatura inicial es Tc= T0+(T1-T0)/N, en contacto con un foco cuya temperatura es Tf=T0+2(T1-T0)/N. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Etapa i
Colocamos el cuerpo de masa m y calor específico c cuya temperatura inicial es Tc= T0+(i-1)(T1-T0)/N, en contacto con un foco cuya temperatura es Tf=T0+i(T1-T0)/N. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Etapa N
Colocamos el cuerpo de masa m y calor específico c cuya temperatura inicial es Tc= T0+(N-1)(T1-T0)/N, en contacto con un foco cuya temperatura es Tf=T1. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Proceso completo
El proceso consta de una sucesión de N estados de equilibrio que lleva al cuerpo desde la temperatura T0 a la temperatura T1. La variación de entropía es
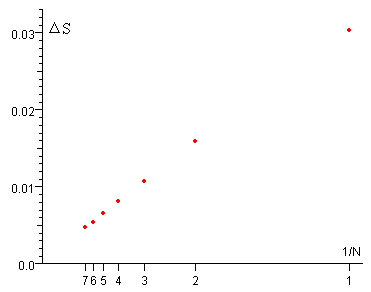
En la figura, se representa:
-
En el eje vertical la variación de entropía ΔS
-
En el eje horizontal la inversa 1/N del número de pasos
Cuando el número N de pasos es muy grande la suma de las variaciones de entropía del foco y del gas tiende a cero. ΔSf+ΔSc→0
Ejemplo:
-
La temperatura inicial del cuerpo es T0=0ºC=273 K
-
La temperatura final es T1=80ºC=353 K
-
La masa m del cuerpo y su calor específico c son tales que el producto m·c=1
Una etapa, N=1
Ponemos el cuerpo a la temperatura inicial de 273 K en contacto con un foco a la temperatura fija de 353 K
Cuatro etapas, N=4
-
Ponemos el cuerpo a la temperatura inicial de 273 K en contacto con un foco a la temperatura de 273+80/4=293 K. La variación de entropía es
-
El cuerpo ha alcanzado la temperatura de 293 K. Lo ponemos en contacto con un foco a la temperatura de 313 K. La variación de entropía es
-
El cuerpo ha alcanzado la temperatura de 313 K. Lo ponemos en contacto con un foco a la temperatura de 333 K. La variación de entropía es
-
El cuerpo ha alcanzado la temperatura de 333 K. Lo ponemos en contacto con un foco a la temperatura de 353 K. La variación de entropía es
La variación de entropía del proceso que consta de cuatro estados de equilibrio es
ΔS= ΔS1+ΔS2+ΔS3+ΔS4=0.0081
Que como vemos es mucho menor que en el proceso de una sola etapa.
Actividades
Se introduce
-
La temperatura final del cuerpo T1, actuando en la barra de desplazamiento titulada Temperatura
-
La temperatura inicial se ha fijado en T0=0ºC=273 K
-
La masa m del cuerpo y su calor específico c se han elegido de modo que el producto m·c=1
Se pulsa el botón titulado Inicio.
- El número de pasos es N=1. El proceso consta de una sucesión de dos estados de equilibrio.
Se pulsa el botón titulado Empieza
- Se pone el cuerpo en contacto con un foco a la temperatura T1. Se observa que la temperatura del cuerpo aumenta hasta alcanzar la temperatura final del foco.
Cuando el cuerpo ha alcanzado la temperatura final de equilibrio, se pulsa el botón titulado Siguiente>>,
- El número de pasos es N=2. El proceso consta de una sucesión de dos estados de equilibrio.
Se pulsa el botón titulado Empieza
y así, sucesivamente
En la parte derecha del applet, se representa
-
En el eje vertical la variación de entropía ΔS
-
En el eje horizontal la inversa 1/N del número de pasos
Cuando el número N de pasos es muy grande la suma de las variaciones de entropía del foco y del gas tiende a cero.
Referencias
Calkin M. G., Kiang D., Entropy change and reversibility. Am. J. Phys. 51 (1) January 1983., pp. 78-79
