El efecto fotoeléctrico
La emisión de electrones por metales iluminados con luz de determinada frecuencia fue observada a finales del siglo XIX por Hertz y Hallwachs. El proceso por el cual se liberan electrones de un material por la acción de la radiación se denomina efecto fotoeléctrico o emisión fotoeléctrica. Sus características esenciales son:
- Para cada sustancia hay una frecuencia mínima o umbral de la radiación electromagnética por debajo de la cual no se producen fotoelectrones por más intensa que sea la radiación.
- La emisión electrónica aumenta cuando se incrementa la intensidad de la radiación que incide sobre la superficie del metal, ya que hay más energía disponible para liberar electrones.
En los metales hay electrones que se mueven más o menos libremente a través de la red cristalina, estos electrones no escapan del metal a temperaturas normales por que no tienen energía suficiente. Calentando el metal es una manera de aumentar su energía. Los electrones "evaporados" se denominan termoelectrones, este es el tipo de emisión que hay en las válvulas electrónicas. Vamos a ver que también se pueden liberar electrones (fotoelectrones) mediante la absorción por el metal de la energía de radiación electromagnética.
El objetivo de la práctica simulada es la determinación de la energía de arranque de los electrones de un metal, y el valor de la constante de Planck. Para ello, disponemos de un conjunto de lámparas que emiten luz de distintas frecuencias y placas de distintos metales que van a ser iluminadas por la luz emitida por esas lámparas especiales.
Descripción
Sea ø la energía mínima necesaria para que un electrón escape del metal. Si el electrón absorbe una energía E, la diferencia E-ø, será la energía cinética del electrón emitido.
Ek=E-ø
Einstein explicó las características del efecto fotoeléctrico, suponiendo que cada electrón absorbía un cuanto de radiación o fotón. La energía de un fotón se obtiene multiplicando la constante h de Planck por la frecuencia fde la radiación electromagnética.
E=hf
Si la energía del fotón E, es menor que la energía de arranque ø, no hay emisión fotoeléctrica. En caso contrario, si hay emisión y el electrón sale del metal con una energía cinética Ek igual a E-ø.
Por otra parte, cuando la placa de área S se ilumina con cierta intensidad I, absorbe una energía en la unidad de tiempo proporcional a IS, basta dividir dicha energía entre la cantidad hf para obtener el número de fotones que inciden sobre la placa en la unidad de tiempo. Como cada electrón emitido toma la energía de un único fotón, concluimos que el número de electrones emitidos en la unidad de tiempo es proporcional a la intensidad de la luz que ilumina la placa
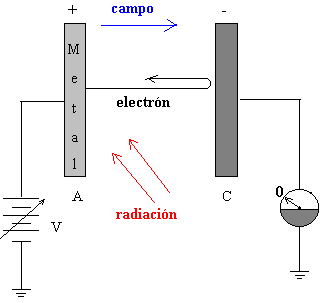
Mediante una fuente de potencial variable, tal como se ve en la figura podemos medir la energía cinética máxima de los electrones emitidos, véase el movimiento de partículas cargadas en un campo eléctrico.
Aplicando una diferencia de potencial V entre las placas A y C se frena el movimiento de los fotoelectrones emitidos. Para un voltaje V0 determinado, el amperímetro no marca el paso de corriente, lo que significa que ni aún los electrones más rápidos llegan a la placa C. En ese momento, la energía potencial de los electrones se hace igual a la energía cinética.
eV0=hf-ø
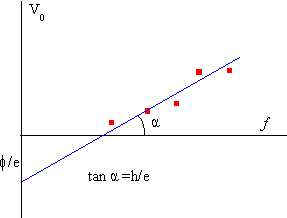
Variando la frecuencia f, (o la longitud de onda de la radiación que ilumina la placa) obtenemos un conjunto de valores del potencial de detención V0. Llevados a un gráfico obtenemos una serie de puntos (potencial de detención, frecuencia) que se aproximan a una línea recta.
La ordenada en el origen mide la energía de arranque en electrón-voltios ø/e. Y la pendiente de la recta es h/e. Midiendo el ángulo de dicha pendiente y usando el valor de la carga del electrón e= 1.6 10-19 C, obtendremos el valor de la constante de Planck, h=6.63 10-34 Js.
Actividades
No es posible disponer de lámparas que emitan a todas las frecuencias posibles, solamente existen lámparas hechas de materiales cuya emisión corresponde a unas determinadas líneas del espectro. Algunas de las líneas de emisión son muy débiles y otras son brillantes.
En las tablas que vienen a continuación se proporcionan los espectros de emisión de metales y gases. La longitud de onda se da en angstrom. Los números en negrita indican las líneas de mayor brillo.
Para realizar la práctica que simula el efecto fotoeléctrico se han de seguir los siguientes pasos:
- Elegir el material de la placa metálica con el que experimentar el efecto fotoeléctrico, en el control selección titulado Cátodo.
- Seleccionar el espectro de emisión del metal o gas en el control de selección titulado Espectro de emisión.
- Seleccionar la intensidad de la radiación un número mayor que cero, en el control de selección titulado Intensidad de la luz. Comprobar que cuando mayor sea la intensidad mayor es la desviación del amperímetro cuando pasa corriente por la fotocélula.
- Pulsar en el botón tituladoNuevo
En la parte izquierda del applet aparecen las líneas más intensas de emisión del metal o gas seleccionado (la longitud de onda está expresada en nm=10-9 m). Con el puntero del ratón señalamos alguna de estas líneas y pulsamos el botón titulado Fotón.
- Si no hay emisión, elegir una línea de emisión de menor de la longitud de onda (mayor frecuencia).
- Si hay emisión, observar el movimiento del electrón. El campo eléctrico frena al electrón y eventualmente, le hace regresar a la placa metálica si su energía cinética no es suficiente.
- Modificar el potencial variable de la batería, introduciendo otro valor en el control de edición titulado Diferencia de potencial, hasta conseguir que el electrón llegue justo a la placa opuesta, el amperímetro deja de marcar el paso de corriente, o empieza a marcar el paso de corriente.
- Guardar el potencial de la batería bien por exceso o por defecto, y la longitud de onda en el control área de texto situada a la izquierda de la ventana, pulsando en el botón titulado Datos.
- Repetir la experiencia introduciendo una nuevo valor para la longitud de onda de la radicación que ilumina la placa metálica.
- Una vez que se han recolectado un número suficiente de datos (cuanto más mejor), se pulsa el botón titulado Enviar para representar gráficamente los datos en el applet situado más abajo.
- Los pares de datos: longitud de onda, potencial de detención, se pueden introducir manualmente en dicha área de texto, separando cada par de datos mediante una coma, y pulsando la tecla Retorno o Enter.
Pulse el botón titulado Enviar para representar gráficamente los datos en el applet situado más abajo.
Resultados
- Pulsar en el botón Calcular, para obtener la representación gráfica de los datos y la recta que mejor ajusta. Si el número de datos es insuficiente, o se ha producido algún error se pulsa en el botón Borrar, para limpiar el área de texto.
- Se obtiene la energía de arranque de los electrones del metal leyendo la ordenada en el origen de la recta trazada, o el valor del parámetro b en la parte superior del applet.
La pendiente de la recta es el valor del parámetro a y mide el cociente entre las constantes fundamentales h/e según se ha explicado en la descripción.
Para obtener el valor de la constante h de Planck, se debe tener en cuenta que el eje horizontal es la frecuencia de la radiación electromagnética en unidades 1014 Hz. La carga del electrón es 1.6·10-19 C. Por tanto, el valor de h se obtiene multiplicando la pendiente a por la carga e y dividiendo por el factor 1014.
h=a·1.6 10-19 ·10-14 Js
Se aconseja al estudiante que haga por sí mismo el tratamiento de los datos de este ejemplo instructivo, representando gráficamente los datos experimentales y determinando la recta de regresión que mejor ajusta. Posteriormente, comparará sus resultados con los del programa interactivo. Los datos de la experiencia se pueden recoger en tablas como la siguiente:
| METAL= | |
| Longitud de onda | Potencial V0 |
| Energía de arranque ø= | |
| Constante de Planck h= | |
Elegir otro metal en el control selección titulado Cátodo, para experimentar otra vez el efecto fotoeléctrico, volviendo a obtener el valor de la constante h de Planck.
