Teoría cinética de los gases
En esta sección estudiaremos un sistema de muchas partículas y consideraremos la conducta promedio de sus constituyentes microscópicos. En particular, se calculará la presión ejercida por el sistema de partículas en términos de los choques que experimentan las moléculas del gas contra las paredes del recipiente.
El objetivo del programa, es el de relacionar las variables presión, volumen y temperatura, en un modelo de gas ideal bidimensional, así como la de conocer la interpretación cinética de la presión y de la temperatura de un gas.
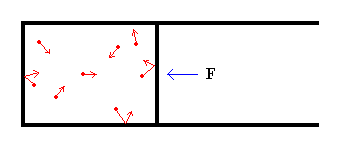
El gas ideal bidimensional está encerrado en un recipiente que dispone de un émbolo móvil, de modo que se puede aumentar o disminuir el volumen (área) del gas. Las moléculas se colocan inicialmente en posiciones aleatorias, las direcciones de sus velocidades también son aleatorias y sus magnitudes son iguales y proporcionales a la raíz cuadrada de la temperatura. Tenemos de este modo un sistema de partículas en equilibrio a la temperatura T, que chocan elásticamente entre sí y con las paredes del recipiente.
El programa calcula el cambio de momento lineal que experimentan las moléculas al chocar con el émbolo y divide este cambio entre el tiempo. El cociente es una medida de la fuerza que ejerce el émbolo sobre las moléculas del gas, o también se puede interpretar como una medida de la presión del gas.
El programa interactivo, también nos permite observar el vector velocidad asociado a
cada molécula y cómo dicho vector cambia de orientación pero no de módulo cuando una
molécula choca con la pared del recipiente, pero cambia de módulo y dirección cuando se
produce una colisión entre dos moléculas.
Vemos que partiendo de una distribución inicial en el que las velocidades de las
moléculas son iguales en módulo, al cabo de un cierto tiempo unas moléculas tienen
mayor velocidad y otras moléculas tienen menor velocidad. La distribución de velocidades
cuando se alcanza el equilibrio sigue la ley
de distribución de Maxwell.
Descripción
El postulado básico de la teoría cinética de los gases es que las direcciones y las magnitudes de las velocidades de las moléculas están distribuidas al azar.
Cuando nos referimos a las velocidades de las moléculas, las medimos respecto del centro de masas del sistema gaseoso, por tanto, la presión y la temperatura del gas no se modifican si el recipiente que lo contiene está en movimiento.
Si suponemos que las velocidades en el sentido positivo del eje X (o del eje Y o Z) son igualmente probables que en el sentido negativo, las velocidades medias a lo largo de los ejes son cero, es decir.
<vx>=<vy>=<vz>=0.
Por otra parte, se cumplirá que las velocidades a lo largo del eje X no estarán relacionadas con las velocidades a lo largo del eje Y o Z, por tanto,
Como el cuadrado del módulo de la velocidad es resulta que
La presión ejercida por el gas
Supongamos que el gas está encerrado en un recipiente, tal como se muestra en la figura. El recipiente dispone de un émbolo móvil de área A. Para mantener fijo el émbolo es necesario ejercer una fuerza F, normalmente a la superficie del émbolo. El valor de la fuerza F es igual al producto de la presión ejercida por el gas por el área del émbolo.
F=PA
Las moléculas del gas chocan elásticamente con el émbolo, de modo que la componente X de la velocidad cambia de sentido. Por tanto, el cambio en el momento lineal de cada molécula es
Δp=2mvx
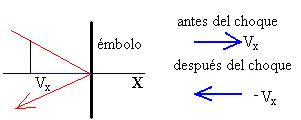
Si el número total de moléculas que chocan con el émbolo en el intervalo de tiempo comprendido entret y t+Δt es Nx, la variación de momento lineal será 2mvxNx.
Podemos calcular Nx considerando que solamente la mitad de las moléculas, en promedio, tienen el sentido de la velocidad hacia la parte positiva del eje X, es decir, se dirigen hacia el émbolo.
Si suponemos que las moléculas que chocan con el émbolo tienen el mismo valor de la componente X de la velocidad, cruzarán el área A en el tiempo Δt todas las partículas contenidas en el volumen AvxΔt. Si n es el número de partículas por unidad de volumen Nx valdrá entonces, nAvxΔt/2.
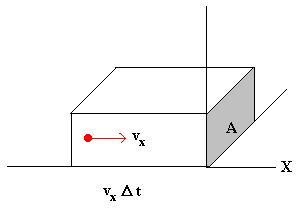
La variación de momento lineal Δp en el intervalo de tiempo comprendido entre t y t+Δt es mvx nAvxΔt.
La fuerza sobre el émbolo es el cociente entre el cambio de momento lineal y el tiempo que tarda en efectuarse dicho cambio.
y por tanto, la presión ejercida por el gas vale
Todas las moléculas no tienen el mismo valor vx de la velocidad, sino que la distribución de velocidades es tal que su valor medio cuadrático es Por tanto, en la expresión de la presión P, hemos de sustituir por .
(1)
ya que
El último término que aparece en la fórmula, es el valor medio de la energía cinética.
Definición cinética de la temperatura
La ecuación de estado de un gas ideal relaciona las propiedades macroscópicas, presión P, el volumen V y temperatura T.
PV=μRT
Siendo μ el número de moles.
El número n de moléculas por unidad de volumen se obtiene dividiendo el número total de moléculas N entre el volumen del recipiente V.
donde N0 el número de Avogadro
Introduciendo n en la expresión de la presión del gas (1), obtenemos
(2)
Comparando esta ecuación con la de estado de un gas ideal, se llega a la definición cinética de temperatura
El cociente entre las dos constantes R y N0 es otra constante que designamos por k, la constante de Boltzmann.
La temperatura absoluta definida, por ejemplo, para un termómetro de gas ideal es una medida directa de la energía media de traslación de las moléculas del gas.
(3)
La temperatura podría medirse en unidades de energía, el hecho de que se mida en grados se debe a la definición tradicional de temperatura, que se estableció antes de que se descubriese la relación antes mencionada.
Otra forma útil de la ecuación de los gases perfectos que se deriva de (2) y (3) es
P·V=N·k·T
Donde N es el número de moléculas contenidas en el recipiente de volumen V.
Como las moléculas de un gas ideal solamente tienen energía cinética, se desprecia la energía potencial de interacción. La energía interna U de un gas ideal es N veces la energía cinética media de una molécula.
Actividades
Se introduce
- El valor de la temperatura del gas ideal, actuando en la barra de desplazamiento titulada Temperatura.
- El "volumen" del recipiente, actuando en la barra de desplazamiento titulada Posición del émbolo.
- El número de partículas, en el control de edición titulado Número de partículas
Se pulsa el botón titulado Empieza
Relacionar la presión y el "volumen" del gas manteniendo constante la temperatura. ¿Se mantiene constante el producto P por V?
Relacionar la presión y la temperatura manteniendo fijo el volumen (la posición del émbolo). ¿Aumenta linealmente la presión con la temperatura?
Para observar el vector velocidad asociado a cada partícula, se introduce en el control de edición titulado Número de partículas, un número pequeño de partículas, por ejemplo 5.
Cuando se pulsa el botón titulado Pausa, se detienen momentáneamente las moléculas para observar el vector velocidad asociado a cada una de ellas. Cuando pulsamos repetidamente el botón titulado Paso, se puede seguir paso a paso el movimiento de las moléculas, podemos observar los choques de las moléculas con las paredes del recipiente y de las moléculas entre sí y como estos sucesos afectan a sus vectores velocidad respectivos.
Pulsando en el botón titulado ahora Continua, se reanuda el movimiento de las moléculas.
