Distribución de las velocidades de las moléculas
Para un gas ideal monoatómico la energía de las moléculas es solamente cinética E=mv2/2.
En la fórmula (1) efectuamos el cambio de variable E por v.
Resultando la expresión
(2)
que es la fórmula de Maxwell para la distribución de velocidades de las moléculas de un gas ideal. Nos proporciona el número dn de moléculas que se mueven con una velocidad comprendida entre v y v+dv independientemente de la dirección del movimiento.
Deducción alternativa
Existe otra manera de deducir la distribución de velocidades de Maxwell
El número de moléculas cuya velocidad está comprendida entre v y v+dv, es decir entre vx y vx+dvx, vy y vy+dvy, vz y vz+dvz, de acuerdo a la ley de Boltzmann es
(3)
donde c es una constante a determinar sabiendo que el número total de moléculas es N. Se efectúa una integral triple entre los límites -∞ y +∞,
Teniendo en cuenta el resultado de la integral
se obtiene
Aplicaciones
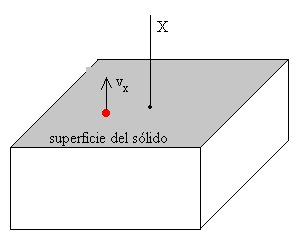 Calculamos el número de moléculas cuya componente X de la velocidad está comprendida entre vx y vx+dvx independientemente de los valores de las otras dos
componentes, integrando respecto de vy y vz entre
los límites -∞ y +∞ .
Calculamos el número de moléculas cuya componente X de la velocidad está comprendida entre vx y vx+dvx independientemente de los valores de las otras dos
componentes, integrando respecto de vy y vz entre
los límites -∞ y +∞ .
La sublimación de un sólido se explica de la siguiente forma: a una temperatura T saldrán de la superficie del cristal aquellos átomos cuya componente X de la velocidad sea positiva y mayor que un valor mínimo vmin, tal que
donde ø es la energía de evaporación de las moléculas en la superficie del cristal
En general, el número de moléculas que tienen una componente X de su velocidad mayor que un valor mínimo se obtiene
erf(x) se denomina función error y viene tabulada en los libros de Matemáticas. Sus valores más notables son:
erf(0)=0, y erf(∞)=1.
El efecto termoiónico es un fenómeno análogo a la sublimación de las moléculas en un sólido, aunque los electrones obedecen a la estadística cuántica de Fermi-Dirac.
El programa interactivo que viene a continuación, calcula 1-erf(x), la complementaria del de la función error cuando se introduce el valor de x en el intervalo [0, ∞).
Programa para calcular 1.0-erf(x)
Velocidad media y velocidad cuadrática media
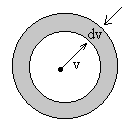 |
En el espacio de velocidades, un elemento de volumen, es el comprendido entre dos esferas de radios v y v+dv, es decir, dv=4π v2dv, tal como se ve en la figura. |
El valor de esta integral, nos permite calcular la constante de proporcionalidad c
La expresión para el número de partículas cuyo módulo de la velocidad esta comprendida entre v y v+dv es
(2)
Que es la misma expresión (2) que hemos obtenido al comienzo de esta sección
Teniendo en cuenta los valores de las integrales
Podemos hallar la velocidad media y de la velocidad cuadrática media.
- La velocidad media
- La velocidad cuadrática media
es la energía media de las moléculas.
La raíz cuadrada del valor medio del cuadrado de las velocidades se denomina vrms
- A partir de la expresión (2) podemos hallar la velocidad para la cual la función de distribución presenta un máximo.
Los datos necesarios para hallar estos valores son los siguientes
Constante de Boltzmann k=1.3805·10-23 J/K
Número de Avogadro NA=6.0225·1023 /mol
| Gas | Peso molecular (M) en g. |
| Hidrógeno (H2) | 2 |
| Oxígeno (O2) | 32 |
| Nitrógeno (N2) | 28 |
| Helio (He) | 4 |
| Neón (Ne) | 10 |
| Argón (Ar) | 18 |
Ejemplo:
Calcular la vrms del oxígeno a 500 ºK
Actividades
- Se selecciona el gas ideal, en el control selección titulado Gas.
- Se introduce la temperatura en kelvin en el control de edición titulado Temperatura.
Se pulsa en el botón titulado Gráfica.
El programa calcula la velocidad vp a la cual la función de distribución presenta un máximo, la velocidad cuadrática media vrms y la velocidad media <v> Representa mediante una línea vertical a trazos la velocidad cuadrática media.
Se pulsa en el botón titulado Borrar para limpiar el área de trabajo del applet.
Ejercicios:
- Comparar la distribución de las velocidades de un gas ideal a distintas temperaturas
- Comparar la distribución de las velocidades de varios gases ideales a la misma temperatura.
