Vibraciones de las moléculas diatómicas
Hemos estudiado el movimiento de los átomos de una molécula diatómica, desde el punto de vista de la Mecánica Clásica.
Resolviendo la ecuación de Schrödinger de un oscilador armónico cuántico hallamos que los niveles de energía dados por la expresión.
Siendo ω0 la frecuencia natural del oscilador armónico
En esta sección vamos a calcular, empleando la fórmula de Boltzmann, la distribución de las moléculas de un gas diatómico entre dichos niveles de energía a una temperatura dada T.
Al ser los niveles de energía equidistantes, la representación mediante un diagrama de barras de la proporción de moléculas que ocupan cada uno de los niveles de energía, nos proporcionará una visión directa del carácter exponencial decreciente de la energía de la ley de Boltzmann.
Descripción
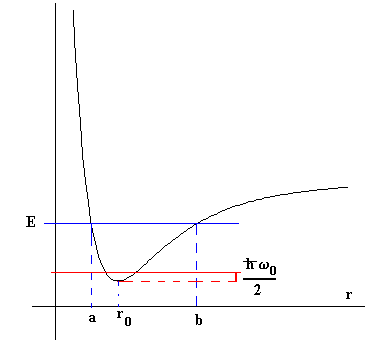
Consideremos una molécula diatómica que tiene una energía potencial como la que se muestra en la figura. Si el movimiento de los núcleos de la molécula corresponde a una energía E, éstos oscilan de modo que clásicamente su separación varía entre Oa y Ob. Sin embargo, se debe describir el movimiento de los núcleos desde el punto de vista de la Mecánica Cuántica. Podemos representar aproximadamente la parte inferior de la curva, por la parábola , siendo r0 la separación de equilibrio, el mínimo de la curva de la energía potencial. En dicha región, el movimiento oscilatorio relativo de los núcleos sería armónico simple, con una frecuencia natural de oscilación de , siendo μla masa reducida de la molécula.
El nivel i tiene una energía que viene dada por la expresión
En consecuencia, los niveles vibracionales de energía de las moléculas son equidistantes.
En la siguiente tabla, se da el intervalo de energía en electrón-voltios, correspondiente a la separación entre dos niveles consecutivos, , de las moléculas.
| Molécula | (eV) |
| Óxido de carbono (CO) | 0.268 |
| Hidrógeno (H2) | 0.543 |
| Oxígeno (O2) | 0.194 |
| Nitrógeno (N2) | 0.292 |
| Cloro (Cl2) | 0.0698 |
| Ácido clorhídrico (ClH) | 0.396 |
La proporción de moléculas que ocupan un nivel dado de energía i es
que podemos expresar como
Calculamos la constante C a partir de la condición de que
Tenemos la suma de los infinitos términos de una progresión geométrica de razón e-x.
La expresión de la proporción ni de moléculas que ocupan un nivel dado i de energía queda finalmente
Actividades
- Se selecciona, el tipo de molécula diatómica en la caja combinada desplegable titulada Molécula.
- Se introduce la temperatura en el control de edición titulado Temperatura.
Se pulsa el botón titulado Calcular.
Se representan los niveles de energía en forma de segmentos horizontales de color negro.
La proporción de moléculas en cada nivel de energía se representa mediante barras horizontales de color rojo.
