Procesos cuasiestáticos (I)
Sea un recipiente cilíndrico de sección S, perfectamente aislado, en posición vertical con un émbolo que separa una parte que está vacía a presión p=0 y la otra parte que contiene un gas.
Si en un momento dado la temperatura absoluta del gas es T y la altura del émbolo es y. La ecuación de los gases ideales, nos relaciona la presión p, el volumen y·S y la temperatura T de una masa de gas o de su número n de moles.
p·S·y =nRT
f·y =nRT
Donde f es la fuerza que ejerce el gas sobre el émbolo debido a la presión
R=8.3143 J/(K·mol) es la constante de los gases
La energía del gas ideal es
El índice γ=5/3 para un gas monoatómico y γ=7/5 para un gas diatómico
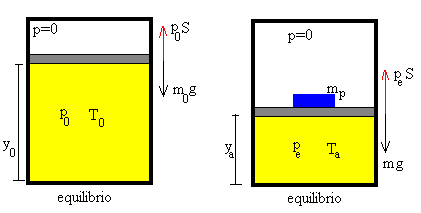
Efectuamos una transformación adiabática entre el estado inicial de equilibrio caracterizado por
-
Una presión p0 o la fuerza sobre el émbolo f0=p0/S debida a la presión del gas f0=m0g
-
Un volumen V0=y0·S o altura del émbolo y0.
-
Una temperatura, T0
-
una energía inicial
Un estado final de equilibrio caracterizado por
-
Una presión pe o la fuerza sobre el émbolo fe=pe/S debida a la presión del gas fe=(m0+mp)g=mg
-
Un volumen Va=ya·S o altura del émbolo ya.
-
Una temperatura Ta
La altura ya del émbolo se calcula a partir de la ecuación de la transformación adiabática
La temperatura Ta a partir de la ecuación de los gases ideales
Proceso de un solo paso
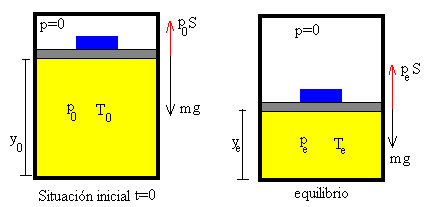
Un bloque de masa mp se coloca sobre el émbolo de masa m0 en la posición inicial y0 con velocidad inicial cero y llega a su posición final de equilibrio ye con velocidad nula.
La ecuación del balance energético, es
En el miembro izquierdo, tenemos la energía inicial (interna del gas y potencial del conjunto bloque-émbolo), a la derecha la energía cinética y potencial del conjunto bloque-émbolo y la energía interna final del gas.
El émbolo llega a la posición de equilibrio estable y=ye después de cierto tiempo. En esta posición de equilibrio, la fuerza f que ejerce el gas sobre el émbolo debida a la presión se anula con el peso del conjunto formado por el bloque y el émbolo f=mg en
La energía potencial del conjunto émbolo-bloque correspondiente a la altura (y0-ye) se convierte enteramente en energía interna del gas en la posición final de equilibrio ye.
ΔEp=(m0+mp)g(y0-ye)
Despejamos la posición final de equilibrio ye de la ecuación de la conservación de la energía,
La temperatura en el estado final de equilibrio, se obtiene a partir de la ecuación de los gases ideales
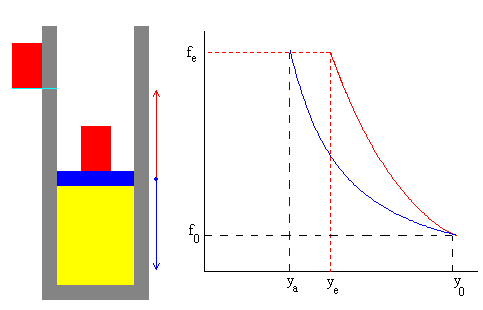
Comparando la transformación adiabática y el proceso de un solo paso, vemos que el estado final tiene la misma presión, pero distintos volúmenes y por tanto, distinta temperatura, tal como puede apreciarse en la figura.
-
La curva de color azul representa la transformación adiabática reversible
-
La curva en color rojo, el proceso de un solo paso.
Proceso de N pasos
Nos aproximaremos al proceso reversible a través de una transformación consistente en una sucesión de N estados de equilibrio que nos conducirán desde el estado inicial al final. Para ello, dividimos el bloque de masa mp en N trozos iguales, que se colocan sucesivamente sobre el émbolo cada vez que se alcanza el equilibrio.
Un proceso irreversible trascurre durante un determinado tiempo, mientras que una transformación consistente en una sucesión de estados de equilibrio puede tener una duración ilimitada.
Dividimos el bloque en N trozos iguales de masa Δm=mp/N, donde mp es la masa del bloque y los vamos colocando sobre el émbolo del siguiente modo:
-
Situación inicial
-
Primera etapa
-
Segunda etapa
-
Etapa N
Partimos de la situación inicial de equilibrio, con el émbolo a una altura y0. La fuerza que ejerce el gas f0 sobre el émbolo debida a la presión se compensa con el peso del émbolo m0g.
Colocamos un trozo del bloque de masa Δm, observamos que comprime el gas y alcanza la posición de equilibrio y1 a la altura.
La fuerza f1 que ejerce el gas debido a la presión, se iguala al peso del conjunto formado por el émbolo y la porción del bloque, f1=(m0+ Δm)g
La posición de equilibrio y1 es ahora la posición inicial cuando se coloca el segundo trozo del bloque de igual masa Δm. Observamos que se comprime el gas y alcanza la posición de equilibrio y2 a la altura.
La fuerza f2 que ejerce el gas debido a la presión, se iguala al peso del conjunto formado por el émbolo y la porción del bloque, f2=(m0+ 2Δm)g
La posición de equilibrio yN-1 es la posición inicial cuando se coloca la última porción N de bloque. Observamos que se comprime el gas y alcanza la posición de equilibrio final yN a la altura.
La fuerza fN que ejerce el gas debido a la presión, se iguala al peso del conjunto formado por el émbolo y la porción del bloque, fN=(m0+NΔm)g
Balance energético
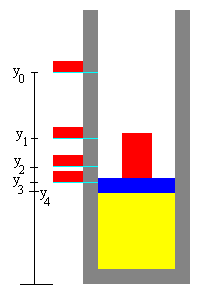
Se coloca la primera porción de bloque de masa Δm en la posición de partida y0, se alcanza el equilibrio en la posición y1.
Se coloca la segunda porción de bloque en la posición y1, se alcanza el equilibrio en la posición y2.
Se coloca la tercera porción de bloque en la posición y2, se alcanza el equilibrio en la posición y3.
Y así, sucesivamente... El proceso consta de una sucesión de N estados de equilibrio
La energía potencial del conjunto formado por el émbolo y de las porciones del bloque que se van colocando sucesivamente sobre el émbolo, se convierte enteramente en energía interna del gas en la posición final de equilibrio yN. El principio de conservación de la energía se escribe
La variación de energía potencial vale (véase la figura)
ΔEp= (m0+Δm)·g·(y0-y1)+ (m0+2Δm)·g·(y1-y2)+ …+(m0+NΔm)·g·(yN-1-yN)
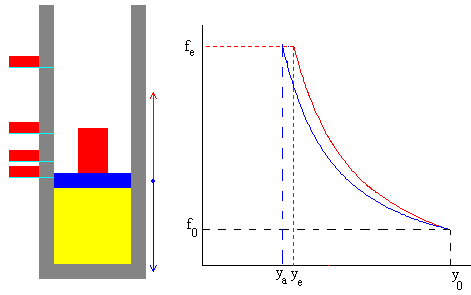
Comparando el proceso reversible y la transformación consistente en una sucesión estados de equilibrio vemos que el estado final tiene la misma presión, pero distintos volúmenes y por tanto, distinta temperatura, tal como puede apreciarse en la figura.
-
La curva de color azul representa la transformación adiabática
-
La curva en color rojo, la sucesión de estados de equilibrio.
Cuanto mayor sea el número de porciones N, en el que se divide el bloque, mayor es el grado de ajuste con el proceso reversible, que conecta los estados inicial y final.
En la parte derecha, se dibujan las fuerzas sobre el émbolo:
-
El peso del conjunto formado por el bloque-émbolo (flecha azul)
-
La fuerza que ejerce la presión del gas sobre el émbolo (flecha roja)
El proceso es una sucesión de N estados de equilibrio. Cuando N es grande, observamos que hay muy poca diferencia entre las dos fuerzas que actúan sobre el émbolo a lo largo de todo el proceso. Naturalmente, en las posiciones de equilibrio son iguales.
De la formulación discreta a la continua
La diferencia entre dos posiciones consecutivas de equilibrio estable, se escribe
Cuando pasamos del límite discreto al continuo
Integrando miembro a miembro
O bien
En un proceso reversible todas las posiciones del émbolo son de equilibrio, por lo que se cumple f=(m0+m)g cuando el émbolo está a una altura y, y f0=m0g en la posición inicial cuando la altura del émbolo es y0.
Esta es la ecuación de una transformación adiabática.
Balance energético
Para n trozos la variación de energía potencial es
La variación de energía potencial se escribe para el límite continuo
Para integrar respecto de la variable y, utilizamos la relación entre y y la masa m del bloque
Comprobamos que se cumple la ecuación de la conservación de la energía para el límite continuo
Actividades
Se introduce
-
El tipo de gas, monoatómico o diatómico, activando el botón de radio correspondiente.
-
La temperatura inicial T0 del gas encerrado en el recipiente, en el control titulado Temperatura
-
La masa del émbolo m0 se ha fijado en un kg.
-
La masa del bloque mp se ha fijado en 5 kg
-
El número de moles se ha fijado en n=0.002 mol
Se pulsa el botón titulado Nuevo.
Se observa el estado inicial de equilibrio, el émbolo está en la posición y0.
-
Se introduce el número N de trozos en el que se ha dividido en bloque de 5 kg, en el control titulado Número de trozos
Se pulsa el botón titulado Nuevo
Se pone el bloque de masa mp sobre el émbolo y observamos su movimiento
Se representan las fuerzas sobre el conjunto émbolo-bloque,
-
El peso (m0+mp)g=mg
-
La fuerza f que ejerce el gas sobre el émbolo debida a la presión
y se proporciona el dato de la resultante f-mg.
Se proporcionan los datos del tiempo y velocidad de émbolo en la parte superior derecha, la temperatura (en kelvin) en la parte inferior del recipiente.
En la parte derecha, se representa la fuerza f que ejerce el gas sobre el émbolo en función de la altura y del émbolo. Se compara con la curva (de color azul) que es la representación de la transformación adiabática f·yγ=cte. La constante se determina conociendo la fuerza f0 (presión) y el desplazamiento y0 (volumen) en el instante t=0.
Ejemplo:
Se introduce
-
La temperatura 20ºC=293 K
-
Se selecciona gas monoatómico
Se pulsa el botón titulado Nuevo
Estado inicial
En el estado inicial de equilibrio, la fuerza que ejerce el gas sobre el émbolo es igual al peso del émbolo
f0=p0·S= m0g=1·9.8 N
Conociendo el número n=0.002 de moles de gas y su temperatura T0=293 K calculamos el volumen o la posición inicial y0 del émbolo, aplicando la ecuación de los gases perfectos, p0·V0=nRT0
Proceso de un solo paso
Se introduce Número de trozos N=1, se coloca el bloque entero sobre el émbolo en la situación inicial
Se pulsa el botón titulado Nuevo.
El émbolo desciende y comprime el gas, hasta que detiene en la posición de equilibrio. El peso del conjunto bloque-émbolo (m0+mp)g se igualan a la fuerza fe que ejerce el gas sobre el émbolo debido a la presión.
fe=(1+5)·9.8 =58.8 N
Como toda la energía potencial del conjunto bloque-émbolo se convierte en energía interna del gas, la posición final de equilibrio se obtiene
Calculamos ahora, la temperatura en esta situación de equilibrio
T1=879.0 K
La energía potencial que se transforma en energía interna es la que corresponde a la altura y0-y1
ΔEp=(m0+mp)g(y0-y1) =6·9.8·(0.497-0.248)=14.61 J
Proceso de N pasos
Partimos del estado inicial del ejemplo anterior
-
Se introduce el número de trozos iguales en el que se ha dividido el bloque, por ejemplo N=4.
Se pone sobre el émbolo una masa Δm=5/4=1.25 kg, en la situación inicial de partida
Se pulsa el botón titulado Nuevo.
-
Primera etapa
-
Segunda etapa
-
Tercera etapa
-
Cuarta etapa
-
Balance energético
El émbolo desciende y comprime el gas, hasta que se detiene su movimiento en la posición de equilibrio. El peso del conjunto bloque-émbolo (m0+Δm)g se iguala a la fuerza f1 que ejerce el gas sobre el émbolo debido a la presión.
f1=(1+1.25)·9.8 =22.05 N
Como toda la energía potencial del conjunto bloque-émbolo se convierte en energía interna del gas, la posición final de equilibrio se obtiene
Calculamos la temperatura en esta situación de equilibrio
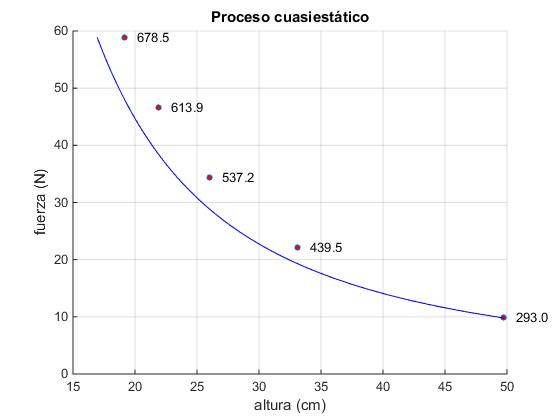
T1=439.5 K
El émbolo con los dos trozos encima se mueve hacia la nueva posición de equilibrio y2
Calculamos la temperatura en esta situación de equilibrio
T2=537.2 K
El émbolo con los tres trozos encima se mueve hacia la nueva posición de equilibrio y2
Calculamos la temperatura en esta situación de equilibrio
T3=613.9 K
El émbolo con los tres trozos encima se mueve hacia la nueva posición de equilibrio y2
Calculamos la temperatura en esta situación de equilibrio
T4=678.5 K
La variación de energía potencial que se transforma en energía interna es
ΔEp= (m0+Δm)·g·(y0-y1)+ (m0+2Δm)·g·(y1-y2)+ (m0+3Δm)·g·(y2-y3)+ (m0+4Δm)·g·(y3-y4)=9.61 J
Esto explica que la temperatura final del gas sea menor. La variación de energía potencial entre la posición inicial y0 y la posición final y4 se puede escribir
Proceso reversible
Una transformación adiabática entre el estado inicial f0=m0g, y0, y el estado final caracterizado por una fuerza debida a la presión fe=mg=(m0+mp)g, es
Te=600.0 K
Comparación de resultados
Estado final de equilibrio
| Variable | Un paso | Cuatro pasos | Proceso reversible |
|---|---|---|---|
| Presión (fuerza) | (1+5)·9.8 N | (1+4·1.25)·9.8 | 6·9.8 |
| Volumen (altura) | 24.8 cm | 19.2 | 16.9 |
| Temperatura | 879.0 K | 678.5 | 600.0 |
Hay diferencia entre el proceso reversible y una transformación consistente en cuatro pasos, pero la diferencia ha disminuido notablemente respecto de la transformación que consta de un solo paso.
Elaboramos un script para realizar la representación gráfica de la transformación adiabática, entre el estado inicial (y0, m0g) y el estado final (ye, (m0+mp)g), junto a la representación gráfica de los estados de equilibrio del final de cada una de las N etapas, (yj, (m0+j·dm)g) en las que se ha dividido el proceso
gamma=5/3; %gas monoatómico, 7/5 para un gas diatómico
nMoles=0.002; %moles de gas
m0=1; %masa del émbolo
mp=5; %masa del bloque en trozos, completo
N=4; %número de trozos en lo que se divide el bloque
dm=mp/N; %masa de cada trozo
y=zeros(N+1,1);
f=zeros(N+1,1);
T=zeros(N+1,1);
%situación inicial
T(1)=293; %temperatura inicial
f(1)=m0*9.8;
y(1)=nMoles*8.3143*T(1)/f(1);
%estado de equilibrio al final de cada etapa
for j=1:N
y(j+1)=y(j)-dm*y(j)/((m0+j*dm)*gamma);
f(j+1)=(m0+mp*j/N)*9.8;
T(j+1)=f(j+1)*y(j+1)*T(1)/(f(1)*y(1));
end
%transformación adiabática
fp=linspace(m0*9.8,(m0+mp)*9.8,50);
yp=((f(1)*y(1)^gamma)./fp).^(1/gamma);
hold on
plot(y*100,f,'o','markersize',4,'markerfacecolor','r')
for j=1:N+1
text(y(j)*100+1,f(j),sprintf('%3.1f',T(j))) %temperatura
end
plot(yp*100,fp,'b')
grid on
hold off
ylabel('fuerza (N)')
xlabel('altura (cm)')
title('Proceso cuasiestático')