Establecimiento del equilibrio
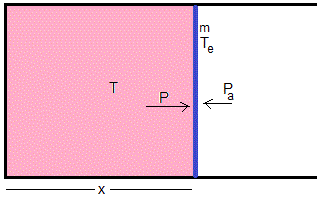
Un cilindro horizontal de sección A contiene un gas ideal a una temperatura inicial T0 y presión P0. Un émbolo de masa m que se puede mover sin rozamiento separa el gas de la atmósfera, cuya presión es constante e igual a Pa. Sea x la posición del émbolo en el instante t y x0 la posición inicial.
El número de moles del gas ideal es
donde R=8.3143 J/(K·mol) es la constante de los gases ideales
Cuando se libera el émbolo, debido a la diferencia de presión entre el gas ideal y de la atmósfera, empieza a moverse. Para determinar la posición x del émbolo en función del tiempo t, supondremos que
La presión y temperatura del gas ideal son uniformes en todo el recipiente en cada instante. La temperatura del émbolo Te es uniforme en cada instante
Cuando la temperatura T del gas es mayor que a temperatura Te del émbolo, fluye calor desde el gas hacia el émbolo y viceversa. Las paredes del cilindro son aislantes y no hay transferencia de calor entre el émbolo y la atmósfera
Evolución del sistema
Se describe el comportamiento del sistema mediante tres ecuaciones diferenciales y la ecuación de estado del gas ideal
La ecuación del movimiento del émbolo es
Transferencia de calor entre el émbolo y el gas
La temperatura del émbolo Te cambia al transferir calor al gas
La ley de Fourier establece que el flujo de calor (energía por unidad de área y unidad de tiempo) es proporcional al gradiente de temperatura.
Suponiendo que la temperatura Te del émbolo es mayor que la del gas ideal T. El calor absorbido por el gas ideal es
donde h es un coeficiente efectivo de transferencia de calor con unidades W/(m2K)
El primer principio para el gas ideal se escribe
cv es el calor específico a volumen constante y P es la presión del gas, P·Ax=nRT
donde ce es el calor específico del émbolo, que supondremos constante
El sistema de tres ecuaciones diferenciales, junto con la ecuación del estado del gas ideal, describen el comportamiento de este sistema. Nos dan la posición del émbolo x, la temperatura del gas T, la presión P del gas y la temperatura Te del émbolo en función del tiempo t
Con las condiciones iniciales siguientes: El émbolo parte del reposo desde la posición x0, la presión inicial del gas es P0 y las temperaturas del gas y del émbolo son iguales a T0
Situación final de equilibrio
Al cabo de un tiempo se establecerá un estado final de equilibrio con el émbolo en reposo dx/dt=0 en la posición xf, las presiones del gas y de la atmósfera serán iguales, Pf=Pa y las temperaturas del gas y del émbolo serán iguales, Tf=Tef
La energía interna del gas habrá cambiado
El trabajo neto de la atmósfera sobre el gas es
El émbolo habrá acumulado calor
Relacionamos estas tres cantidades. El trabajo de la atmósfera se invierte en cambiar la energía interna del gas ideal y en acumular calor en el émbolo
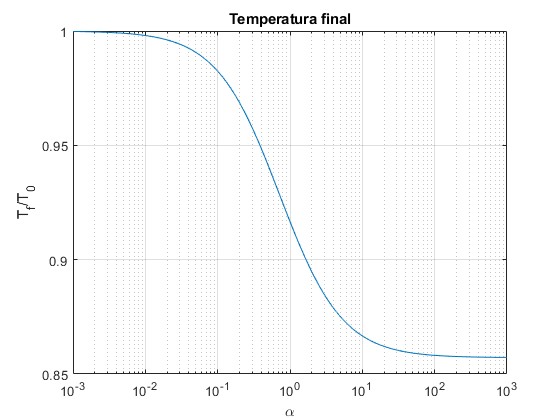
- El gas se expande. Si xf>x0 entonces Tf<T0
- El gas se comprime. Si xf<x0 entonces Tf>T0
Relación entre la temperatura inicial T0 y la final Tf
- Si P0>Pa entonces Tf<T0
- Si P0<Pa entonces Tf>T0
- Calor específico a volumen constante cv=5R/2, cp=7R/2
- Presión inicial P0/Pa=2
Definimos el parámetro α y teniendo en cuenta la relación entre los calores específicos molares cp=cv+R
cualquiera que sea el valor de α (número positivo)
Cuando el parámetro α es pequeño, α→0, o es grande, α→∞
Ejemplo
Representamos la temperatura final Tf/T0 en función de α
p0=2; %P0/Pa
cv=2.5; %cv/R
cp=3.5;
%temperatura Tf/T0
T=@(x) (cp/cv+1./x+(1/p0-1)/cv)./(cp/cv+1./x);
x=logspace(-3,3,100);
semilogx(x,T(x))
grid on
xlabel('\alpha')
ylabel('T_f/T_0');
title('Temperatura final')
Relación entre la posición inicial x0 y la final xf
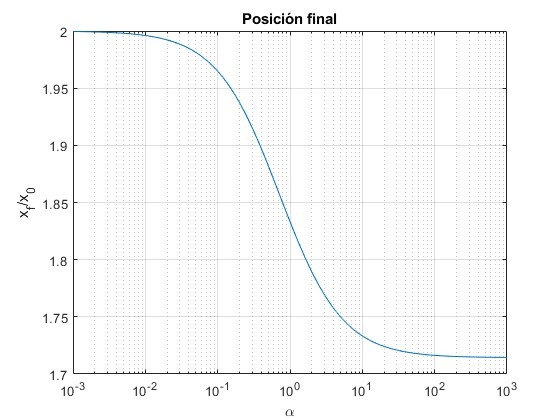
- xf=x0 para P0=Pa (no hay movimiento del émbolo)
- xf>x0 para P0>Pa, el gas se expande
- xf<x0 para P0<Pa, el gas se comprime
Cuando el parámetro α es pequeño, α→0, o es grande, α→∞
Ejemplo
- Calor específico a volumen constante cv=5R/2, cp=7R/2
- Presión inicial P0/Pa=2
Representamos la posición final xf/x0 en función de α
p0=2; %P0/Pa
cv=2.5; %cv/R
cp=3.5;
%posición final xf/x0
xf=@(x) (cp/cv+1./x+(1./x+1)*(p0-1))./(cp/cv+1./x);
x=logspace(-3,3,100);
semilogx(x,xf(x))
grid on
xlabel('\alpha')
ylabel('x_f/x_0');
title('Posición final')
Entropía
Variación de entropía del gas
Variación de entropía del émbolo
Variación total de entropía
Solución numérica del sistema de ecuaciones diferenciales
Antes de resolver las ecuaciones, es conveniente expresarlas en términos de magnitudes adimensionales
La ecuación de estado
Ecuación del movimiento. Primera ecuación diferencial
Segunda ecuación diferencial
Tercera ecuación diferencial
Expresamos el sistema de ecuaciones diferenciales en términos de las variables ξ, Γ, Γe, utilizando la ecuación de estado pξ=p0Γ
Dados los valores de cv/R, α y tc/th, se resuelve el sistema de ecuaciones diferenciales con las condiciones iniciales, τ=0, ξ=1, dξ/dτ=0, (el émbolo inicialmente en reposo) y Γ=Γe=1, (la temperatura del gas y del émbolo es la misma) p0 (presión inicial del gas)
Ejemplo
- Presión inicial, p0=2
- Parámetro, α=0.01
- Calor específico a volumen constante, cv/R=5/2, a presión constante cp/R=7/2
Temperaturas finales del gas y del émbolo
Posición final
Incremento de entropía
El gas se expande y se comprime reversiblemente. La transferencia de calor del gas al émbolo o viceversa, es el único proceso irreversible
Otro dato que precisamos es el cociente tc/th=0.1
Resolvemos el sistema de tres ecuaciones diferenciales mediante el procedimiento
% x(1) es xi, x(2) es dxi/dtau, x(3) es T (temperatura gas), x(4) es T_e
% (temperatura émbolo)
p0=2;
k1=0.1; %cociente t_c/t_h
cv=2.5; %c_v/R
alfa=0.01;
fg=@(t,x)[x(2); p0*x(3)/x(1)-1; -k1*(x(3)-x(4))-x(3)*x(2)/(cv*x(1));
alfa*k1*(x(3)-x(4))];
[t,x]=ode45(fg,[0,300],[1,0,1,1]);
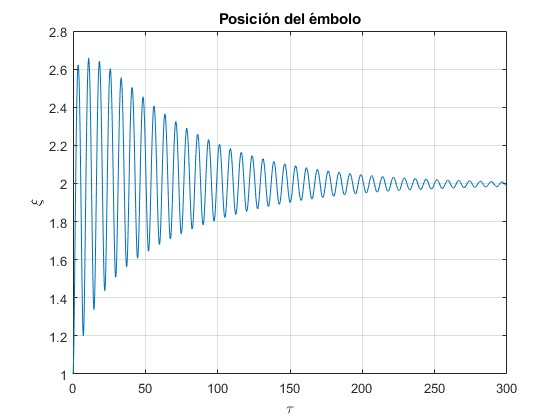
plot(t,x(:,1))
grid on
xlabel('\tau')
ylabel('\xi');
title('Posición del émbolo')
figure
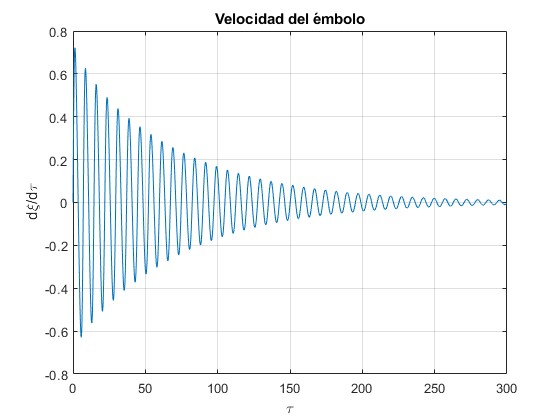
plot(t,x(:,2))
grid on
xlabel('\tau')
ylabel('d\xi/d\tau');
title('Velocidad del émbolo')
figure
hold on
plot(t,x(:,3))
plot(t,x(:,4))
hold off
legend('gas','émbolo','Location', 'best')
grid on
xlabel('\tau')
ylabel('\Gamma');
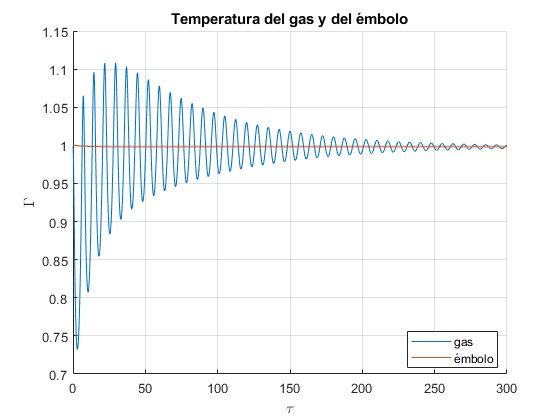
title('Temperatura del gas y del émbolo')
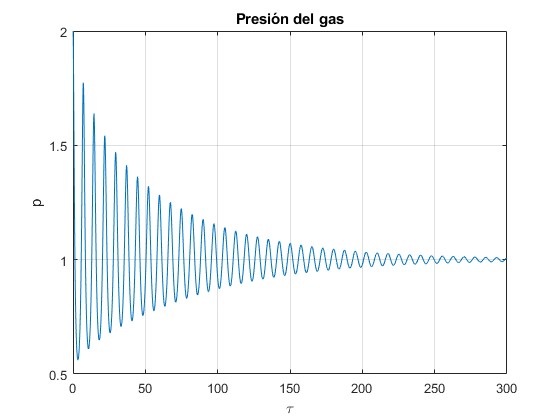
figure
plot(t,p0*x(:,3)./x(:,1))
grid on
xlabel('\tau')
ylabel('p');
title('Presión del gas')
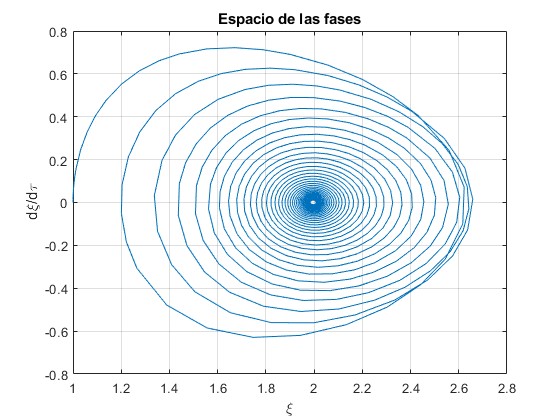
figure
plot(x(:,1),x(:,2))
grid on
xlabel('\xi')
ylabel('d\xi/d\tau');
title('Espacio de las fases')
Posición del émbolo ξ en función del tiempo τ
Velocidad del émbolo dξ/dτ en función del tiempo τ
Velocidad del émbolo dξ/dτ en función de la posición ξ
Presión p del gas en función del tiempo τ
Temperatura del gas Γ y del émbolo Γe
Probar otras situaciones por ejemplo, cambiando el cociente tc/th=1, 10, variable
Investigamos el efecto del cociente tc/th manteniendo fijo el parámero α=0.01.
p0=2;
alfa=0.01;
cv=2.5; %c_v/R
hold on
for k1=[0.0001, 1,1000] %cociente t_c/t_h
fg=@(t,x)[x(2); p0*x(3)/x(1)-1; -k1*(x(3)-x(4))-x(3)*x(2)/(cv*x(1));
alfa*k1*(x(3)-x(4))];
[t,x]=ode45(fg,[0,100],[1,0,1,1]);
plot(x(:,1),x(:,2))
end
hold off
grid on
ylabel('d\xi/d\tau')
legend('0.0001','1','1000','Location', 'southeast')
xlabel('\xi');
title('Espacio de las fases')
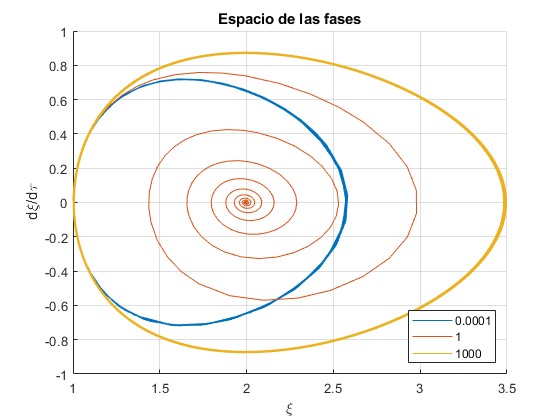
Cuando el cociente tc/th tiende a cero o tiende al infinito, el émbolo oscila, sin alcanzar el estado final de equilibrio
Actividades
Se introduce
- Se elige gas ideal, monoatómico cv=3R/2, diatómico, cv=5R/2
- Presión inicial del gas, p0 en el control tituladp Presión
- El valor del parámetro α en el control tiulado Parámetro
- El valor del cociente th/tc en el control tiulado Cociente
Se pulsa el botón titulado Nuevo
Referencias
David S. Corti, Joshua A. Ciesar, Juan M. Vazquez. Thermal damping of the motion of a piston: Any irreversibility implies dissipation. Am. J. Phys. 92, pp. 214–220, March 2024

