Enfriamiento de un gas
Imaginemos un gas compuesto por N0 moléculas que ocupan un recipiente a la temperatura T0. La distribución de equilibrio es
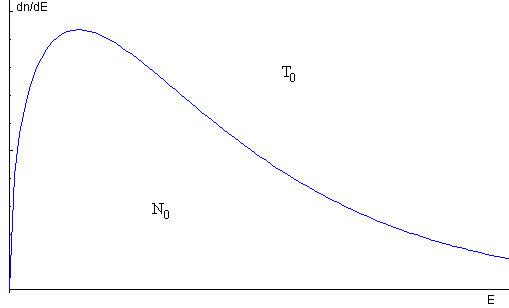
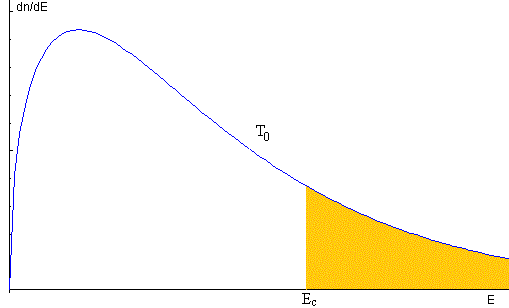
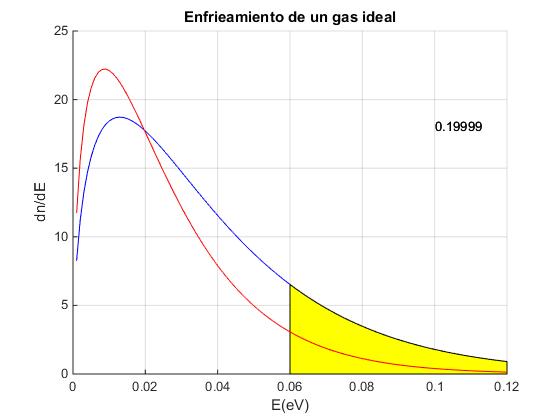
Por algún procedimiento (véase el artículo citado en las referencias) se retiran del recipiente todas las moléculas que se muevan con una velocidad superior a vc o tengan una energía superior a Ec (en color azul en la figura) quedando N1 moléculas en el recipiente.
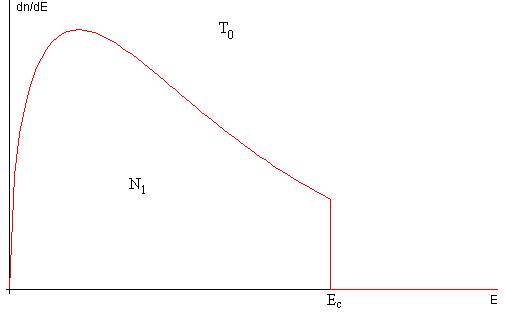
Las N1 moléculas que permanecen en el recipiente están inicialmente en una situación de no equilibrio tal como se muestra en la figura, más abajo
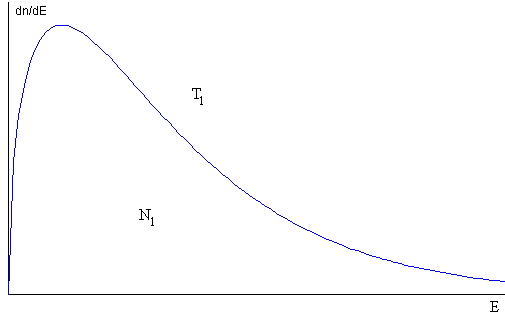
Las N1 moléculas que permanecen en el recipiente chocan entre sí y vuelven a adoptar la distribución de equilibrio a una temperatura inferior T1
La energía antes y después alcanzar la distribución de equilibrio no cambia, de modo que
Dada la energía Ec, calculamos la temperatura T1 de las N1 moléculas del gas que permenecen en el recipiente.
En la página anterior hemos calculado la integral de la derecha, para obtener la energía interna U de N moléculas de un gas a la temperatura T
Sustituimos N1 y despejamos T1
Hacemos el cambio de variable x=E/kT
El número de partículas que permanece en el recipiente es
La temperatura T1 del gas compuesto por N1 moléculas es
Tomando T0=300 K y Ec=0.06 eV, entonces xc=2.32
>> syms x xc; >> y=x^(3/2)*exp(-x); >> num=int(y,0,xc); >> y=x^(1/2)*exp(-x); >> den=int(y,0,xc); >> t1=2*num/(3*den); >> subs(t1,xc,2.32)*300 ans = 202.0198
Resolvemos la integral del denominador
Se hace el cambio de variable y2=x
Se integra por partes
>> syms x xc;
>> int('x^(1/2)*exp(-x)',x,0,xc)
ans =(pi^(1/2)*erf(xc^(1/2)))/2 - xc^(1/2)*exp(-xc)
Resolvemos la integral del numerador
>> syms x xc;
>> int('x^(3/2)*exp(-x)',x,0,xc)
ans =
(3*pi^(1/2)*(erf(xc^(1/2)) - 1))/4 + (3*pi^(1/2))/4 -
(xc^(1/2)*exp(-xc)*(2*xc + 3))/2
La temperatura T1 es
>> xc=2.32; >> T1=300*(erf(sqrt(xc))*3*sqrt(pi)/2-(2*xc^1.5+3*sqrt(xc))*exp(-xc))... /(erf(sqrt(xc))*3*sqrt(pi)/2-3*sqrt(xc)*exp(-xc)) T1 = 202.0198
El número de moléculas
Establecemos la temperatura inicial del gas T0
Se representa la función de distribución de las moléculas dn/dE con la energía E expresada en electrón-voltios eV
Establecemos la energía Ec de corte o mínima de las moléculas que se van a eliminar del recipiente
La proporción de moléculas que van a ser eliminadas, es el cociente entre el área bajo la curva de la distribución señalada en color amarillo y el área total bajo la curva.
Se proporciona el dato de la proporción de moléculas eliminadas en la parte superior derecha de la imagen.
La distribución inicial de no equilibrio, se convierte en una distribución de equilibrio a una temperatura inferior, debido a los choques entre las molécula del gas contenido en el recipiente.
Se proporciona el dato de la nueva temperatura T1 y de la proporción de moléculas que permanecen en el recipiente, N1/N0.
Se compara la distribución de equilibrio a la temperatura T0 (en color azul) con la distribución actual a la temperatura T1 (en color rojo).
El estado final es el estado inicial para una nueva iteracción. Se establece una nueva energía de corte Ec (o se mantiene el mismo valor). De este modo, vamos enfriando el gas a la vez que van eliminando las moléculas más energéticas del mismo.
T0=300; %temperatura inicial
Ec=0.06; %energía de corte en eV
N0=1;
xc=Ec*11604.49/T0;
T1=T0*(3*sqrt(pi)*erf(sqrt(xc))-(4*xc*sqrt(xc)+
6*sqrt(xc))*exp(-xc))/(3*(sqrt(pi)*erf(sqrt(xc))-2*sqrt(xc)*exp(-xc)));
N1=N0*(erf(sqrt(xc))-2*sqrt(xc)*exp(-xc)/sqrt(pi));
fprintf('Temperatura: %3.1f, permanecen %1.3f\n',T1,N1);
T=T0;
N=N0;
pr=1-2*(sqrt(pi)*erf(sqrt(xc))/2-sqrt(xc)*exp(-xc))/sqrt(pi); %proporción
%distribución de equilibrio a la temparatura T0
f=@(x) 2*N*sqrt(x).*exp(-11604.49*x/T)*1250083.9/(sqrt(pi)*T^(3/2));
E=(0.1:0.1:12)/100;
y=f(E);
hold on
plot(E,y, 'b')
%se eliminan las moléculas cuya energía E>Ec, señaladas en la gráfica
xx=[Ec Ec E(E>Ec & E<0.12) 0.12 0.12];
yy=[0 f(Ec) y(E>Ec & E<0.12) f(0.12) 0];
fill(xx,yy,'y'); %rellena un área de color especificado
text(0.1,18,num2str(pr));
T=T1;
N=N1;
%distribución de equilibrio a la temparatura T1
f=@(x) 2*N*sqrt(x).*exp(-11604.49*x/T)*1250083.9/(sqrt(pi)*T^(3/2));
y=f(E);
plot(E,y, 'r')
hold off
grid on
xlabel('E(eV)')
ylabel('dn/dE')
title('Enfriamiento de un gas ideal')
Temperatura: 202.1, permanecen 0.800
Referencias
Henn E. A., Seman J. A., Ramos E. R. F., Iavaronni A. H., Amthor T., Bagnato V. S., Evaporation in atomic traps: A simple approach. Am. J. Phys. 75 (10) October 2007, pp. 907-910

