Procesos cuasiestáticos (III)
Proceso de un solo paso
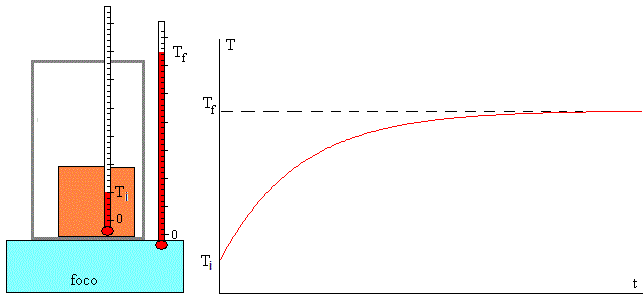
Colocamos un cuerpo de masa m y calor específico c cuya temperatura inicial es Ti en contacto con un foco (ambiente) cuya temperatura es Tf
Como hemos estudiado en la página titulada “Ley del enfriamiento de Newton” al cabo de un cierto tiempo (teóricamente infinito) el cuerpo alcanza la temperatura Tf.
T=Tf+(Ti-Tf)·exp(-k·t)
El cuerpo absorbe una cantidad de calor
Q=m·c·(Tf-Ti)
La variación de entropía del cuerpo es
El foco de calor cede una cantidad de calor Q sin cambiar su temperatura Tf. Su variación de entropía es
La variación de entropía del sistema formado por el cuerpo y el foco es
ΔS= ΔSc+ΔSf>0
Proceso de N pasos
Para calentar un cuerpo de masa m y calor específico m desde una temperatura inicial T0 hasta una temperatura final TN, lo ponemos en contacto con N focos a las temperaturas T1, T2, T3,...TN, tal como se muestra en la figura
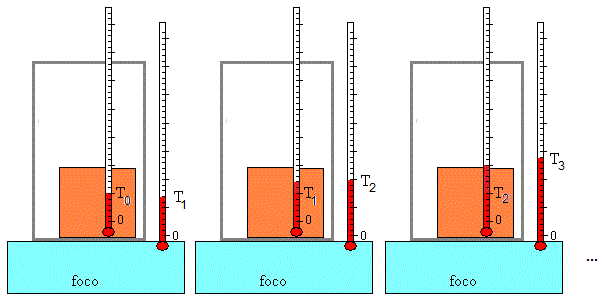
Primer paso
Colocamos un cuerpo de masa m y calor específico c cuya temperatura inicial es Ti=T0 en contacto con un foco cuya temperatura es Tf=T1. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Segundo paso
Colocamos el cuerpo de masa m y calor específico c cuya temperatura inicial es Ti=T1, en contacto con un foco cuya temperatura es Tf=T2. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Etapa k
Colocamos el cuerpo de masa m y calor específico c cuya temperatura inicial es Ti=Tk-1, en contacto con un foco cuya temperatura es Tf=Tk. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Etapa N
Colocamos el cuerpo de masa m y calor específico c cuya temperatura inicial es Ti=TN-1, en contacto con un foco cuya temperatura es Tf=TN. Al cabo de cierto tiempo, el cuerpo alcanza la temperatura del foco Tf
La variación de entropía del sistema formado por el cuerpo y el foco es
Proceso completo
El proceso consta de una sucesión de N estados de equilibrio que lleva al cuerpo desde la temperatura T0 a la temperatura TN. La variación de entropía es la suma ΔS= ΔS1+ΔS2+ΔS3+...ΔSN
En la variación de la entropía del cuerpo (primer sumando de ΔSi) el numerador del término i es el denominador del término i+1, al sumar los logaritmos se cancelan, por ejemplo, ln(a/b)+ln(c/a)=ln(c/b)
Progresión aritmética
En este caso, la temperatura del foco k es Tk=T0+k(TN-T0)/N, k=1,2,3...N
Primer paso
La temperatura inicial es Ti=T0 y la del foco es Tf=T0+(TN-T0)/N.
Segundo paso
La temperatura inicial es Ti= T0+(TN-T0)/N y la del foco es Tf=T0+2(TN-T0)/N.
Etapa k
La temperatura inicial es Ti= T0+(k-1)(TN-T0)/N y la del foco Tf=T0+k(TN-T0)/N.
Etapa N
La temperatura inicial es Ti= T0+(N-1)(TN-T0)/N, en contacto con un foco cuya temperatura es Tf=TN.
Proceso completo
Ejemplo:
- La temperatura inicial del cuerpo es T0=0ºC=273 K
- La temperatura final es TN=80ºC=353 K
- La masa m del cuerpo y su calor específico c son tales que el producto m·c=1
Una etapa, N=1
Ponemos el cuerpo a la temperatura inicial de 273 K en contacto con un foco a la temperatura fija de 353 K
Cuatro etapas, N=4
-
Ponemos el cuerpo a la temperatura inicial de 273 K en contacto con un foco a la temperatura de 273+80/4=293 K. La variación de entropía es
-
El cuerpo ha alcanzado la temperatura de 293 K. Lo ponemos en contacto con un foco a la temperatura de 313 K. La variación de entropía es
-
El cuerpo ha alcanzado la temperatura de 313 K. Lo ponemos en contacto con un foco a la temperatura de 333 K. La variación de entropía es
-
El cuerpo ha alcanzado la temperatura de 333 K. Lo ponemos en contacto con un foco a la temperatura de 353 K. La variación de entropía es
La variación de entropía del proceso que consta de cuatro estados de equilibrio es
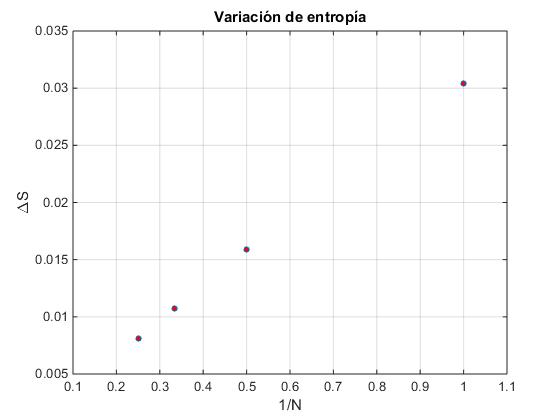
ΔS= ΔS1+ΔS2+ΔS3+ΔS4=0.0081
>> N=4; >> T0=273; >> TN=353; >> i=1:4; >> log(TN/T0)-(TN-T0)*sum(1./((N-i)*T0+i*TN)) ans = 0.0081
Que como vemos es mucho menor que en el proceso de una sola etapa.
Elaboramos un script para representar:
- En el eje vertical la variación de entropía ΔS
- En el eje horizontal la inversa 1/N del número de pasos
N=4;
SS=zeros(N+1,1);
S=zeros(N+1,1);
T0=273; %temperatura inicial del cuerpo
TN=353; %temperatura final
S(1)=0;
for k=1:N
for j=1:k
Ti=T0+(j-1)*(TN-T0)/k; %temperatura inicial en cada etapa
Tf=T0+j*(TN-T0)/k; %temperatura final en cada etapa
S(j+1)=S(j)+log(Tf/Ti)-(Tf-Ti)/Tf;
end
%variación de entropía total del proceso de k etapas
SS(k)=S(k+1);
end
x=1./(1:N);
plot(x,SS(1:N),'o','markersize',4,'markerfacecolor','r')
xlim([0.1,1.1])
grid on
hold off
ylabel('\DeltaS')
xlabel('1/N')
title('Variación de entropía')
Cuando el número N de pasos es muy grande la suma de las variaciones de entropía del foco y del gas tiende a cero. ΔSf+ΔSc→0
Actividades
Se introduce
-
La temperatura final del cuerpo TN, en el control titulado Temperatura
-
La temperatura inicial se ha fijado en T0=0ºC=273 K
-
La masa m del cuerpo y su calor específico c se han elegido de modo que el producto m·c=1
Se pulsa el botón titulado Nuevo.
- El número de pasos es N=1. El proceso consta de una sucesión de dos estados de equilibrio.
Se pulsa el botón titulado ►
- Se pone el cuerpo en contacto con un foco a la temperatura T1. Se observa que la temperatura del cuerpo aumenta hasta alcanzar la temperatura final del foco.
Cuando el cuerpo ha alcanzado la temperatura final de equilibrio, se pulsa el botón titulado >>
- El número de pasos es N=2. El proceso consta de una sucesión de dos estados de equilibrio.
Se pulsa el botón titulado ►
y así, sucesivamente
En la parte derecha, se representa
-
En el eje vertical, la variación de entropía ΔS
-
En el eje horizontal, la inversa 1/N del número de pasos
Cuando el número N de pasos es muy grande la suma de las variaciones de entropía del foco y del gas tiende a cero.
Progresión geométrica
En este caso, la temperatura del foco k es
Seguimos los mismos pasos que en el apartado la progresión aritmética. La variación de entropía del proceso completo de N pasos es
Modificamos el script anterior, cambiando solamente dos líneas del código, las temperaturas inicial Ti y final Tf, en progresión aritmética por progresión geométrica
N=4;
SS=zeros(N+1,1);
S=zeros(N+1,1);
T0=273; %temperatura inicial del cuerpo
TN=353; %temperatura final
S(1)=0;
for k=1:N
for j=1:k
Ti=T0*(TN/T0)^((j-1)/k); %temperatura inicial en cada etapa
Tf=T0*(TN/T0)^(j/k); %temperatura final
S(j+1)=S(j)+log(Tf/Ti)-(Tf-Ti)/Tf;
end
%variación de entropía total del proceso de k etapas
SS(k)=S(k+1);
end
x=1./(1:N);
plot(x,SS(1:N),'o','markersize',4,'markerfacecolor','r')
%xlim([0.1,1.1])
grid on
hold off
ylabel('\DeltaS')
xlabel('1/N')
title('Variación de entropía')
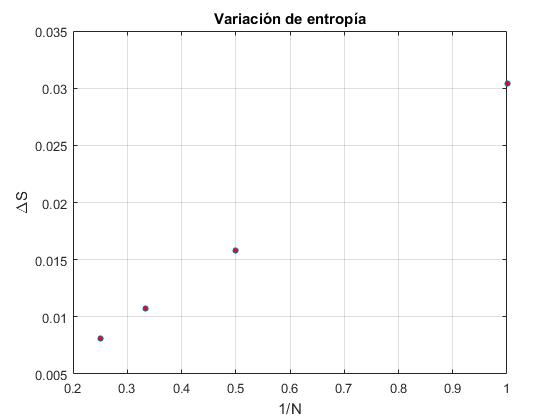
Obtenemos unos resultados similares, lo que indica que lo más relevante es el número N de focos y no la temperatura (comprendida entre la inicial T0 y la final TN) de los mismos.
>> log(TN/T0)+N*((T0/TN)^(1/N)-1) ans = 0.0081 >> SS(N) ans = 0.0081
Cuando el número N de pasos es muy grande la suma de las variaciones de entropía del foco y del gas tiende a cero, ΔSf+ΔSc→0, como demostraremos a continuación
Calculamos la variación de entropía ΔS, en el límite cuando N→∞. Llamamos s al segundo sumando
entonces
Llamamos ahora, x=N/s
En el límite, cuando x→∞ o N→∞. La expresión entre corchetes es el número e
La variación de entropía del proceso completo cuando N→∞ es nula, el proceso es reversible
Referencias
Calkin M. G., Kiang D., Entropy change and reversibility. Am. J. Phys. 51 (1) January 1983., pp. 78-79
E N Miranda. When an irreversible cooling (o heating) becomes reversible. Eur. J. Phys. 21 (2000) pp. 239-243

