El átomo de hidrógeno
El estado de un electrón de masa me alrededor de un núcleo de masa mp se describe mediante la ecuación de Schrödinger en coordenadas esféricas
Donde μ es la masa reducida y r es la distancia entre el electrón y el núcleo.
La energía potencial V(r) del único electrón de un átomo de hidrógeno o ion hidrogenoide (He+, Li++, ...) de número atómico Z es
En este apartado, estudiaremos el átomo de hidrógeno Z=1, y supondremos que el núcleo es el centro fijo de fuerzas de atracción electrostática
Para resolver la ecuación de Schrödinger transformaremos una ecuación diferencial en derivadas parciales en un sistema de tres ecuaciones diferenciales dependientes unicamente de las variables r, θ y φ, respectivamente
En primer lugar, supondremos que la solución de la ecuación de Schrödinger es el producto de dos funciones: una que describe el estado del electrón en la dirección radial r y otra en la dirección angular (θ, φ)
Separamos la variable r de las variables θ y φ
La parte izquierda no depende de (θ, φ) y la parte derecha no depende de r, por tanto, ambas términos se igualan a una constante que denominamos λ1. La ecuación diferencial en derivadas parciales se transforma en el sistema de dos ecuaciones diferenciales
La parte angular
Supondremos que la solución Y(θ, φ) de la segunda ecuación diferencial en derivadas parciales es el producto de dos funciones que dependen solamente de θ y φ, respectivamente
La parte angular se estudia en la página titulada La ecuación de Schrödinger en coordenadas esféricas con λ1=l(l+1), y m=0, ±1, ±2, ...±l es decir, 2l+1 valores
Los primeros armónicos esféricos son
Parte radial
Hay que resolver la ecuación diferencial
Hacemos el cambio de variable r=aρ. Denominaremos R(r)= u(ρ)
Donde a0 es el radio de Bohr
Comportamiento asintótico
Cuando ρ es grande
Cuando ρ es pequeño
La solución de esta ecuación diferencial es
El coeficiente A deberá ser cero, para que la solución sea finita para ρ→∞. Cuando ρ es grande u(ρ) es proporcional a
Buscamos una solución de la forma u=ρs, obtenemos la ecuación de segundo grado
s(s-1)-l(l+1)=0. Las raíces de la ecuación de segundo grado en s son
La segunda no puede ser ya que ρ-l→∞ cuando ρ→0. Cerca del origen el comportamiento de u(ρ) es proporcional a ρl+1
Conociendo el comportamiento asintótico, buscamos una solución para la ecuación diferencial radial de la forma
La ecuación diferencial en u(ρ) se convierte en
Hacemos otro cambio de variable llamando y(x) a v(ρ)
Llamando a , la ecuación diferencial se transforma en
Si n es un entero positivo, las energías permitidas son
El mismo resultado que en el modelo de Bohr
Polinomios asociados de Laguerre
La ecuación diferencial y su solución, los polinomios asociados de Laguerre, son
Generamos los polinomios asociados con el siguiente código
syms x k;
for n=0:3
for m=0:n
disp([n,m])
pol_n_m=factorial(n+m)*symsum((-1)^k*x^k/(factorial(n-k)*
factorial(m+k)*factorial(k)),k,0,n)
end
end
0 0 pol_n_m =1
1 0 pol_n_m =1 - x
1 1 pol_n_m =2 - x
2 0 pol_n_m =x^2/2 - 2*x + 1
2 1 pol_n_m =x^2/2 - 3*x + 3
2 2 pol_n_m =x^2/2 - 4*x + 6
3 0 pol_n_m =- x^3/6 + (3*x^2)/2 - 3*x + 1
3 1 pol_n_m =- x^3/6 + 2*x^2 - 6*x + 4
3 2 pol_n_m =- x^3/6 + (5*x^2)/2 - 10*x + 10
3 3 pol_n_m =- x^3/6 + 3*x^2 - 15*x + 20
Solución de la ecuación diferencial en y(x)
Ahora estamos en condiciones de encontrar la solución de la ecuación diferencial en y(x), a continuación en v(ρ), en u(ρ) y finalmente, R(r)
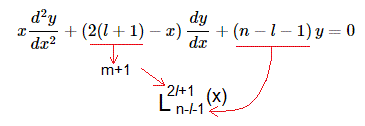
La solución son los polinomios asociados de Laguerre
Con los cambios de variable que hemos efectuado
Multiplicamos la última expresión por un factor para que los paréntesis contengan la misma variable,
Es conveniente expresar R(r) en términos del cociente r/a0 en vez de r/a, donde a0 es el radio de Bohr
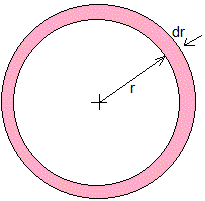
El coeficiente A se determina haciendo que
El volumen de una capa esférica comprendida entre r y r+dr es 4πr2·dr
Aunque existe una fórmula para el coeficiente A para cualquier n y l al igual que para los armónicos esféricos, esta es muy complicada de obtener, por lo que calcularemos la integral con la ayuda de MATLAB
Calculamos las primeras funciones Rm,l(r)
>> syms a x; >> assume(a,'positive') >> int(x^2*exp(-2*x/a),x,0,inf) ans =a^3/4
>> int(x^2*exp(-x/a)*(2-x/a)^2,x,0,inf) ans =8*a^3
>> int(x^2*exp(-x/a)*(x/a)^2,x,0,inf) ans =24*a^3
>> int(x^2*exp(-2*x/(3*a))*(2*(x/a)^2/9-2*(x/a)+3)^2,x,0,inf) ans =(243*a^3)/4
>> int(x^2*exp(-2*x/(3*a))*(2*x/(3*a))^2*(-2*x/(3*a)+4)^2,x,0,inf) ans =486*a^3
>> int(x^2*exp(-2*x/(3*a))*(2*x/(3*a))^4,x,0,inf) ans =2430*a^3
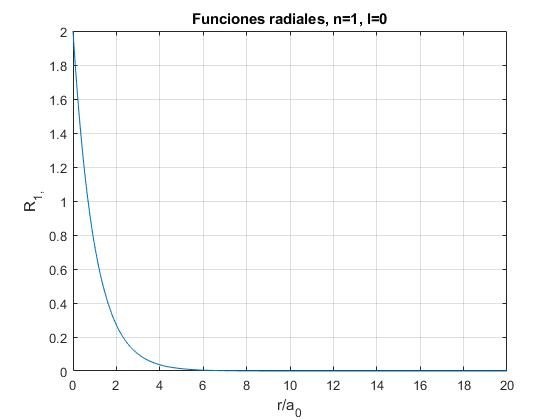
Representamos las primeras funciones , en función del cociente r/a0
f=@(x) 2*exp(-x);
fplot(f,[0,20])
grid on
xlabel('r/a_0')
ylabel('R_{1,}')
title('Funciones radiales, n=1, l=0')
figure
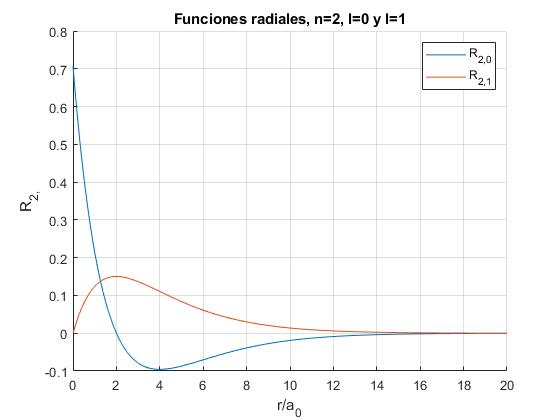
f1=@(x) (2-x).*exp(-x/2)/(2*sqrt(2));
f2=@(x) x.*exp(-x/2)/(2*sqrt(6));
hold on
fplot(f1,[0,20])
fplot(f2,[0,20])
hold off
grid on
xlabel('r/a_0')
ylabel('R_{2,}')
legend('R_{2,0}', 'R_{2,1}')
title('Funciones radiales, n=2, l=0 y l=1')
figure
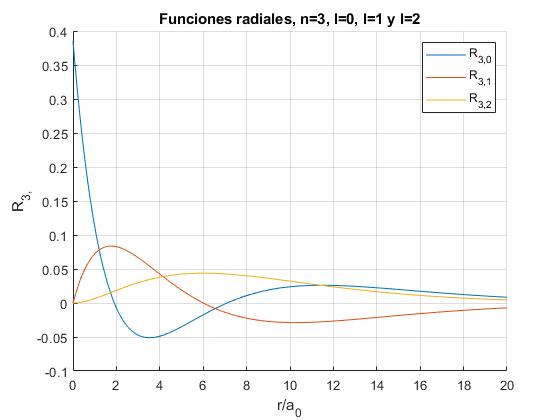
f1=@(x) (2*x.^2-18*x+27).*exp(-x/3)*2/(81*sqrt(3));
f2=@(x) (6-x).*x.*exp(-x/3)*4/(81*sqrt(6));
f3=@(x) (x.^2).*exp(-x/3)*4/(81*sqrt(30));
hold on
fplot(f1,[0,20])
fplot(f2,[0,20])
fplot(f3,[0,20])
hold off
grid on
xlabel('r/a_0')
ylabel('R_{3,}')
legend('R_{3,0}', 'R_{3,1}', 'R_{3,2}')
title('Funciones radiales, n=3, l=0, l=1 y l=2')
Combinando la solución radial y angular
En general
Para cada valor de n que especifica un nivel de energía, hay n valores diferentes del momento angular, desde l=0 hasta l=n-1. El número cuántico l está relacionado con el módulo del momento angular L
Al resolver la ecuación diferencial de la parte angular, ya se ha especificado los posibles valores de m=0, ±1, ±2, ±3,... ±l. El número cuántico m está relacionado con la componente Lz, es decir, la dirección del momento angular
Las primeras funciones son
Estas funciones cumplen
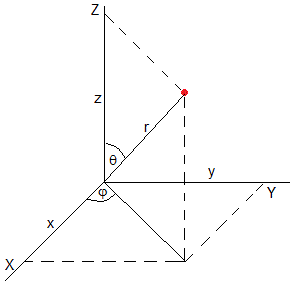
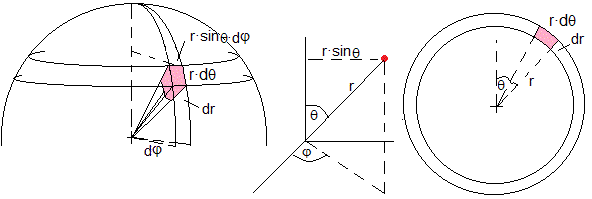
En la figura, el elemento de volumen dV=dr·rdθ·(rsinθ·dφ)=r2sinθ·dφ·dθ en coordenadas esféricas, el ángulo φ varía entre 0 y 2π, el ángulo θ, entre 0 y π
Referencias
R. L. Herman. The Three-dimensional Schödinger Equation. November 7, 2016

