Calor latente de fusión
Cambios de estado
Normalmente, una sustancia experimenta un cambio de temperatura cuando absorbe o cede calor al ambiente que le rodea. Sin embargo, cuando una sustancia cambia de fase absorbe o cede calor sin que se produzca un cambio de su temperatura. El calor Q que es necesario aportar para que una masa m de cierta sustancia cambie de fase es igual a
Q=mL
donde L se denomina calor latente de la sustancia y depende del tipo de cambio de fase.
Por ejemplo, para que el agua cambie de sólido (hielo) a líquido, a 0ºC se necesitan 334·103 J/kg. Para que cambie de líquido a vapor a 100 ºC se precisan 2260·103 J/kg.
En la siguiente tabla, se proporcionan los datos referentes a los cambios de estado de algunas sustancias.
| Sustancia | T fusión ºC | Lf ·103 (J/kg) | T ebullición ºC | Lv ·103 (J/kg) |
|---|---|---|---|---|
| Hielo (agua) | 0 | 334 | 100 | 2260 |
| Alcohol etílico | -114 | 105 | 78.3 | 846 |
| Acetona | -94.3 | 96 | 56.2 | 524 |
| Benceno | 5.5 | 127 | 80.2 | 396 |
| Aluminio | 658.7 | 322-394 | 2300 | 9220 |
| Estaño | 231.9 | 59 | 2270 | 3020 |
| Hierro | 1530 | 293 | 3050 | 6300 |
| Cobre | 1083 | 214 | 2360 | 5410 |
| Mercurio | -38.9 | 11.73 | 356.7 | 285 |
| Plomo | 327.3 | 22.5 | 1750 | 880 |
| Potasio | 64 | 60.8 | 760 | 2080 |
| Sodio | 98 | 113 | 883 | 4220 |
Fuente: Koshkin N. I., Shirkévich M. G.. Manual de Física elemental, Edt. Mir (1975) págs. 74-75.
Los cambios de estado se pueden explicar de forma cualitativa del siguiente modo:
En un sólido los átomos y moléculas ocupan las posiciones fijas de los nudos de una red cristalina. Un sólido tiene en ausencia de fuerzas externas un volumen fijo y una forma determinada.
Los átomos y moléculas vibran, alrededor de sus posiciones de equilibrio estable, cada vez con mayor amplitud a medida que se incrementa la temperatura. Llega un momento en el que vencen a las fuerzas de atracción que mantienen a los átomos en sus posiciones fijas y el sólido se convierte en líquido. Los átomos y moléculas siguen unidos por las fuerzas de atracción, pero pueden moverse unos respecto de los otros, lo que hace que los líquidos se adapten al recipiente que los contiene pero mantengan un volumen constante.
Cuando se incrementa aún más la temperatura, se vencen las fuerzas de atracción que mantienen unidos a los átomos y moléculas en el líquido. Las moléculas están alejadas unas de las otras, se pueden mover por todo el recipiente que las contiene y solamente interaccionan cuando están muy próximas entre sí, en el momento en el que chocan. Un gas adopta la forma del recipiente que lo contiene y tiende a ocupar todo el volumen disponible.
Un ejemplo clásico en el que se utilizan los conceptos de calor específico y calor latente es el siguiente:
Determinar el calor que hay que suministrar para convertir 1g de hielo a -20 ºC en vapor a 100ºC. Los datos son los siguientes:
- Calor específico del hielo ch=2090 J/(kg K)
- Calor de fusión del hielo Lf=334·103 J/kg
- Calor específico del agua c=4180 J/(kg K)
- Calor de vaporización del agua Lv=2260·103 J/kg
Etapas:
- Se eleva la temperatura de 1g de hielo de -20ºC (253 K) a 0ºC (273 K)
- Se funde el hielo
- Se eleva la temperatura del agua de 0º C (273 K) a 100 ºC (373 K)
- Se convierte 1 g de agua a 100ºC en vapor a la misma temperatura
Q1=0.001·2090·(373-253)=41.8 J
Q2=0.001·334·103=334 J
Q3=0.001·4180·(373-273)=418 J
Q4=0.001·2260·103=2260 J
El calor total Q=Q1+Q2+Q3+Q4=3053.8 J.
Si disponemos de una fuente de calor que suministra una energía a razón constante de q J/s podemos calcular la duración de cada una de las etapas
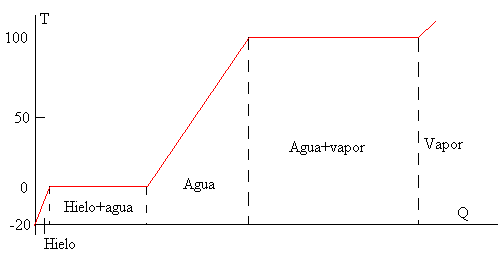
En la figura, que no se ha hecho a escala, se muestra cómo se va incrementando la temperatura a medida que se aporta calor al sistema. La vaporización del agua requiere de gran cantidad de calor como observamos en la gráfica y en los cálculos realizados en el ejemplo.
| Calor, Q | Temperatura, T |
|---|---|
| 0 | -20 |
| 41.8 | 0 |
| 375.8 | 0 |
| 793.8 | 100 |
| 3053.8 | 100 |
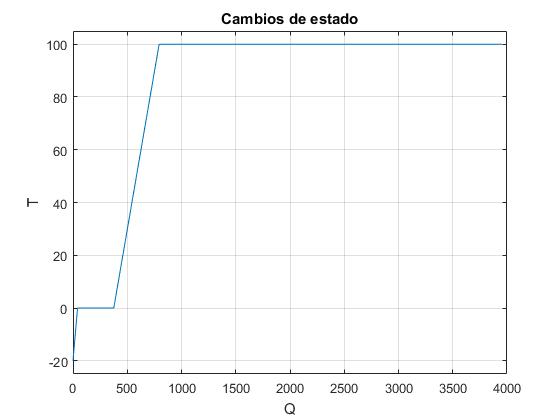
>> T=[-20, 0,0,100,100];
>> Q=[0,41.8,375.8,793.8,3953.8];
>> plot(Q,T);
>> ylim([-25,105]);
>> xlabel('Q');
>> ylabel('T');
>> grid on
>> title('Cambios de estado')
Medida del calor latente de fusión (I)
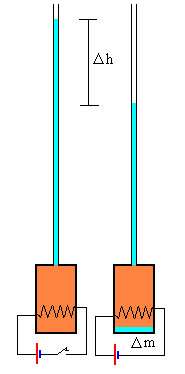
Se llena un termo con hielo y se cierra. A través del tapón se pasa un largo tubo de vidrio de pequeña sección S y dos cables que conectan con una resistencia por la que circula una corriente eléctrica que calienta el hielo para convertirlo en agua a 0ºC.
Se añade agua a través del tubo para rellenar la botella y propio el tubo.
En la parte izquierda de la figura, se muestra la situación inicial. En la parte derecha, la situación al cabo de un cierto tiempo t después de conectar la resistencia a una batería.
La resistencia eléctrica calienta el hielo, se funde y el volumen del sistema disminuye, como consecuencia, pasa agua del tubo de vidrio al termo. Medimos la variación de altura del agua en el tubo vertical graduado.
El experimento consiste en medir la energía necesaria para reducir el volumen del sistema en una determinada cantidad a temperatura constante y a presión constante.
En el estado inicial tenemos una masa M de hielo de densidad ρh=0.917 g/cm3 en un volumen V0.
M= ρh·V0
Al cabo de un cierto tiempo t, una masa Δm de hielo se ha convertido en agua de densidad ρa=1.0 g/cm3, El volumen V del sistema disminuye
La variación de volumen, en valor absoluto, es
Para fundir una masa Δm de hielo y convertirla en agua se necesita una cantidad de calor
Q=Lf·Δm
donde Lf es el calor latente de fusión
Al disminuir el volumen del sistema, el agua del tubo vertical entra en el termo, disminuyendo la altura en ΔV=SΔh
Medimos el calor Q que suministra la resistencia eléctrica en el tiempo t.
Q=i2·R·t
Medimos la variación de la altura Δh de agua en el tubo de vidrio vertical y despejamos el calor latente de fusión Lf
Ejemplo:
- La sección del tubo vertical vale S=0.1782 cm2
- La densidad del hielo ρh=0.917 g/cm3
- La densidad del agua ρa=1.0 g/cm3
Se precisan Q=13140 J para que el nivel de agua en el tubo vertical disminuya Δh=20 cm
Actividades
Se ha fijado
- La sección del tubo vertical vale S=0.1782 cm2
- La densidad del hielo ρh=0.917 g/cm3
- La densidad del agua ρa=1.0 g/cm3
Se introduce
-
La potencia P=i2R W, en el control titulado Potencia
Se pulsa el botón titulado Nuevo
Se observa que a medida que se va fundiendo el hielo y convirtiéndose en agua en el recipiente, va descendiendo el nivel de agua en el tubo vertical de vidrio.
En la parte derecha, hay un contador de la energía disipada por la resistencia que funde el hielo.
Medida del calor latente de fusión (II)
Se introduce una masa m de hielo a un calorímetro con agua a una temperatura T ligeramente por encima de la temperatura ambiente Ta y se agita la mezcla hasta que el hielo se funde completamente. Se elige la masa m del hielo de modo que la temperatura Te de equilibrio esté ligeramente por debajo de la temperatura ambiente, es decir, de modo que T-Ta≈T-Te.
De este modo, el calor cedido al ambiente en la primera etapa de la experiencia se compensa con el calor ganado en la segunda etapa.
En la experiencia que se describe a continuación, se emplea el procedimiento de las mezclas pero no se tiene en cuenta las pérdidas o ganancias de calor entre el calorímetro y el medio ambiente.
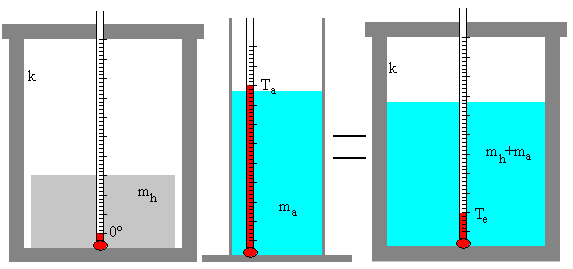
Una masa ma de agua a la temperatura inicial Ta se mezcla con una masa mh de hielo a 0º C en un calorímetro. La mezcla de agua y hielo se agita hasta que se alcanza una temperatura final de equilibrio Te.
Pueden ocurrir dos casos:
-
Se funde una parte m de la masa inicial mh de hielo, quedando una mezcla formada por hielo (mh-m) y agua (ma+m) a la temperatura final de Te=0ºC.
- El calor absorbido por el hielo es Q1=m·Lf
- El calor cedido por el agua es Q2=ma·c·(0-Ta)
-
Si se funde todo el hielo, el estado final es una masa (mh+ma) de agua a la temperatura final Te>0.
- El calor absorbido por el hielo es Q1=mh·Lf+ mh·c·(Te-0)
- Calor absorbido por el calorímetro Q2= k·c·(Te-0)
- El calor cedido por el agua es Q3=ma·c·(Te-Ta)
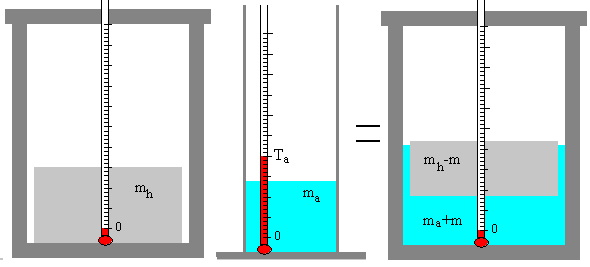
Si el calorímetro está perfectamente aislado, no pierde ni gana calor, se cumplirá que
(1)
Ahora hemos que tener en cuenta que la masa mh de hielo se convierte en agua y a continuación, eleva su temperatura de 0ºC a Te. Por otra parte, el calorímetro (su masa equivalente en agua k) eleva su temperatura de 0º C a Te.
Si el calorímetro está perfectamente aislado, no pierde ni gana calor, se cumplirá que
(2)
En la página “calor específico de un sólido”, ya se ha explicado el significado de masa equivalente k en agua del calorímetro.
Actividades
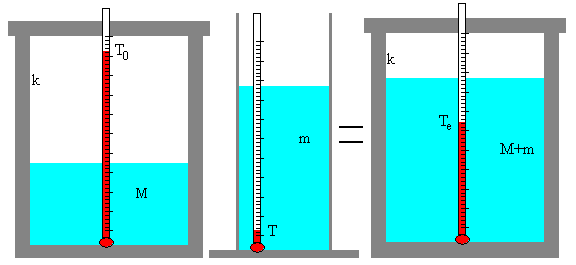
- Medida del equivalente en agua del calorímetro
- Masa M de agua en gramos en el calorímetro,
- Temperatura T0 inicial del calorímetro
- Masa m de agua en gramos en una probeta
- Temperatura T del agua
- Sea M=170 g, T0=92.7 ºC
- Sea m=170 g, y T=2.7 ºC
- La temperatura de equilibrio es Te=54.2ºC
- Medida del calor de fusión
- Masa mh de hielo en gramos en el calorímetro,
- Temperatura inicial del hielo se fija en 0ºC
- Masa ma del agua en gramos
- Temperatura Ta del agua
- Hielo: mh=128 g,
- Agua, ma=170 g, y Ta=80ºC
- Se funde todo el hielo y la temperatura final de equilibrio es Te=9.5 ºC
- La masa equivalente en agua del calorímetro la hemos calculada en el apartado anterior k=57.4 g
Introducimos los siguientes datos:
Se pulsa el botón titulado Prepara, los termómetros y las escalas graduadas de medida del volumen de agua reflejan los datos introducidos.
Si estamos conformes, se pulsa el botón titulado Calcula. La masa m de agua se vierte en el calorímetro y el termómetro mide la temperatura final de equilibrio Te.
Ejemplo:
El equivalente en agua del calorímetro será
Introducimos los siguientes datos:
Se pulsa el botón titulado Prepara.
Si estamos conformes, se pulsa el botón titulado Calcula. El agua se vierte en el calorímetro y el termómetro mide la temperatura final de equilibrio Te.
En el caso de que solamente una parte del hielo se fundiese, la temperatura final sería Te=0ºC. Se podría extraer el hielo del calorímetro, y pesarlo en una balanza. Conocida la masa m de hielo se determinaría el calor de fusión mediante la fórmula (1). Cuando se produzca esta situación, se incrementa la masa de agua o su temperatura o ambas cosas a la vez, hasta conseguir que todo el hielo del calorímetro se funda.
Ejemplo:
Referencias
Soules J. A. Improved sophomore experiment to measure latent heat of fusion. Am. J. Phys. 35 (1967) pp. 23-26
Güemez, Fiolhais C., Fiolhais M. Revisiting Black's experiments on the latent heats of water. The Physics Teacher Vol 40, January 2002, pp. 26-31

