Cañón de vapor de agua
El dispositivo consiste en un tubo cilíndrico de hierro de diámetro interno d=20 cm, longitud L=1 m, de masa mt=20 kg, cerrado por su extremo izquierdo y que supondremos anclado al suelo para evitar retrocesos en el proceso de lanzamiento.
Se coloca dentro del tubo una bala de hierro de masa mb=2 kg, que encaja perfectamente y sin rozamiento con las paredes del tubo y que está inicialmente a distancia a=50 cm de la base del tubo, creando una cámara hermética en la que previamente se han introducido 100 ml de agua. El resto de la cámara contiene aire y una cantidad inicialmente despreciable de vapor de agua.
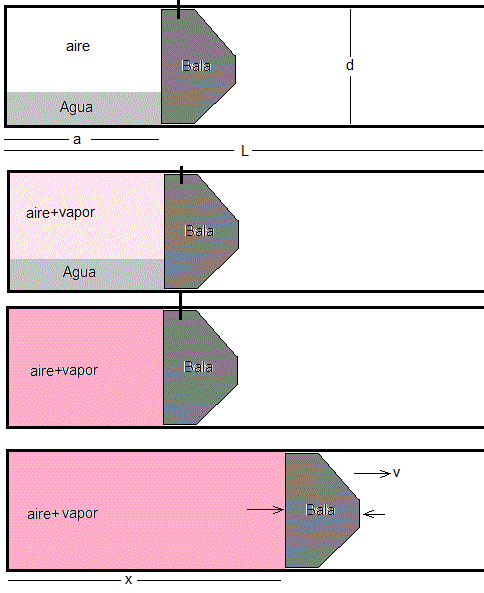
La temperatura inicial del cañón (tubo, bala, agua y aire) es T1=20 °C y la presión inicial en la cámara es la atmosférica, p1=1 atm. Se conecta al cañón una fuente de calor que le comunica una energía por unidad de tiempo k=5·103 J/s.
Suponemos que todo el sistema se calienta de forma homogénea. Consideraremos en todo el problema que tanto el aire como el vapor de agua se comportan como gases ideales.
Datos
- densidad del agua, ρa=1000 kg/m2
- masa molecular del agua, Ma=0.018 kg/mol
- masa molecular del aire, Maire=0.029 kg/mol
- presión atmosférica, 1 atm=101 325 Pa
- temperatura del cero absoluto, T0=- 273.15 °C=0 K
- constante de los gases ideales, R=8.31 J/(kg·K)
- calor latente de vaporización del agua, L= 40·103 J/mol=2.22·106 J/kg
- calor específico del agua, ca=4 180 J/(kg·K)
- calor específico del hierro, cFe=450 J/(kg·K)
- calor específico a volumen constante del vapor, cv=1 410 J/(kg·K)
- calor específico a volumen constante del aire, caire= 720 J/(kg·K)
- coeficiente adiabático del vapor, γ=1.324
- coeficiente adiabático del aire, γ=1.4
Primera figura, calculamos el número de moles de agua y el número de moles de aire que hay inicialmente dentro del cañón
Segunda figura, elevamos la temperatura a T2=150 °C
Tercera figura, elevamos la temperatura a T3 hasta que todo el agua se convierte en vapor
Se calienta aún más hasta alcanzar la temperatura de T4=300 °C
Estado del sistema para varias temperaturas
Como hay 100 ml de agua su volumen será Va=0.0001 m3, y su masa será ma=0.1 kg. El número de moles es la masa dividida por la masa molecular:
El volumen de la cámara es Vtotal=π(d/2)2a=0.0157 m3. El volumen que ocupa el aire es Vaire=Vtotal-Va=0.0157-0.0001=0.0156 m3 que es prácticamente el volumen total. La temperatura inicial es 20 °C
La densidad del aire es
La presión de vapor de agua pv se relaciona con la temperatura T por medio de la ecuación de Clausius-Clapeyron
donde pv está expresada en Pa y T en K, la constante L es el calor latente de vaporización del agua y R es la constante de los gases ideales. (Se comprueba que a 100 °C la presión de vapor es 1 atm.). La presión de vapor a 150 °C es
Aunque ya se ha evaporado algo de agua, ésta ocupa un volumen despreciable y podemos considerar que el volumen que ocupa el aire y el vapor es prácticamente el mismo que el inicial. La presión del aire es
La presión total dentro de la cámara será la suma de la presión del aire y la presión de vapor:
ptotal=paire2+pv2=1.44+4.59=6.043 atm
El número de moles de vapor es
Por tanto, quedan 5.56-2.06=3.5 moles de agua sin evaporar
Seguimos calentando hasta una temperatura T3, justo a la cual toda el agua líquida se ha evaporado y ya sólo hay vapor en la cámara del cañón.
Cuando se ha evaporado toda el agua, el número de moles de vapor es igual al número inicial de moles de agua es decir, nv=na=5.56 moles. El vapor ocupará todo el volumen de la cámara, Vtotal. Según la ecuación de los gases ideales, la presión del vapor y la temperatura cumplirán
Resolvemos la ecuación transcendente
hold on
fplot(@(t) 2943*(t+273.15)/101325,[150, 250])
fplot(@(t) 4.05e10*exp(-4813.5./(t+273.15))/101325,[150, 250])
f=@(t) 2943*(t+273.15)-4.05e10*exp(-4813.5/(t+273.15));
T3=fzero(f,[150,250]);
pv=2943*(T3+273.15)/101325;
plot(T3,pv,'ro','markersize',3,'markerfacecolor','r')
line([T3,T3],[0,pv],'lineStyle','--')
line([150,T3],[pv,pv],'lineStyle','--')
disp([T3, 2943*(T3+273.15)])
hold off
grid on
xlabel('t')
ylabel('p_v (atm)')
title('Solución gráfica')
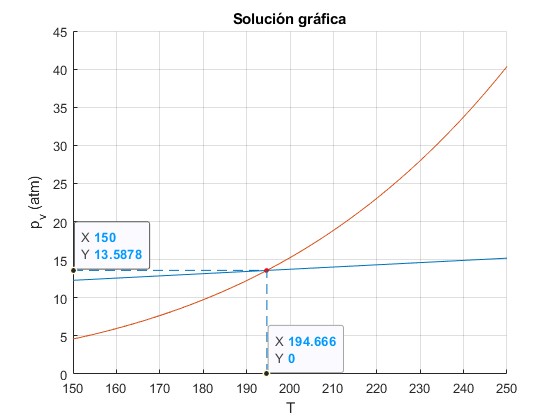
194.6657 13.5878
La temperatura buscada T3=194.7 °C≈195 °C y la presión de vapor pv3=13.6 atm
Representamos la presión de vapor pv en función de la temperatura en el intervalo 20 a 194.6 °C
pv=@(t) exp(40e3*(1/373.15-1./(t+273.15))/8.31);
fplot(pv,[20,194.6])
grid on
xlabel('t')
ylabel('p_v (atm)')
title('Presión de vapor')
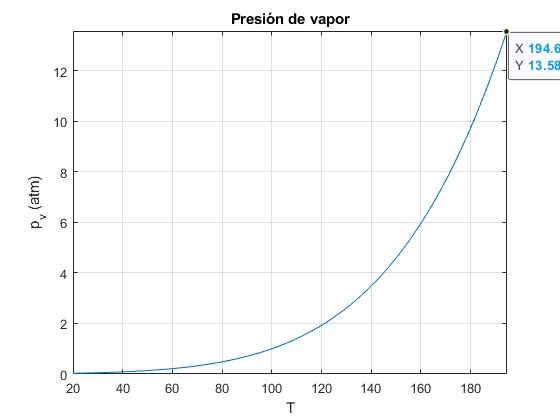
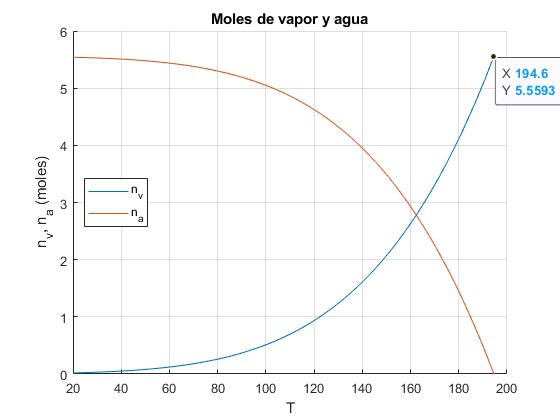
Representamos el número de moles de vapor nv y de agua na en función de la temperatura en el intervalo 20 a 194.6 °C
pv=@(t) 101325*exp(40e3*(1/373.15-1./(t+273.15))/8.31);
nv=@(t) pv(t).*(0.0157-5.56*0.018/1000)./(8.31*(t+273.15)-
pv(t)*0.018/1000);
hold on
fplot(nv,[20,194.6]) %moles de vapor
na=@(t) 5.56-nv(t);
fplot(na,[20,194.6]) %moles de agua
hold off
grid on
xlabel('t')
ylabel('n_v, n_a (moles)')
legend('n_v','n_a', 'Location','best')
title('Moles de vapor y agua')
La presión parcial del vapor es
La presión parcial del aire es
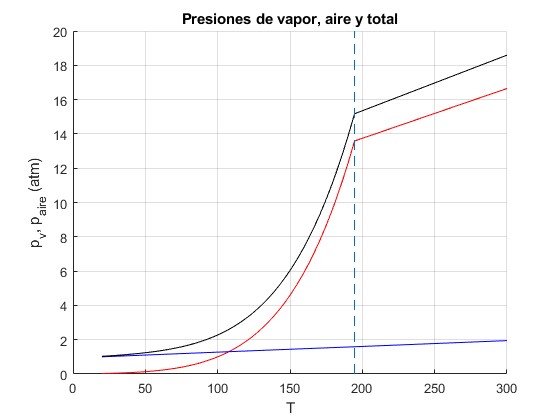
La presión total es pt=16.6+1.9=18.5 atm
La presión en función de la temperatura
Representamos la presión parcial de vapor pv (en atm) en función de la temperatura (color rojo) en el intervalo 20 a 300 °C
Representamos la presión parcial del aire paire (en atm) en función de la temperatura (color azul) en el intervalo 20 a 300 ºC
El número de moles de vapor nv en función de la temperatura se ha dterminado en el punto anterior
La presión total (color negro) es la suma de las dos presiones parciales
pv_1=@(t) exp(40e3*(1/373.15-1./(t+273.15))/8.31);
nv=@(t) 101325*pv_1(t).*(0.0157-5.56*0.018/1000)./
(8.31*(t+273.15)-101325*pv_1(t)*0.018/1000);
hold on
p_aire_1=@(t) 0.65*8.31*(273.15+t)./
((0.0157-(5.56-nv(t))*0.018/1000)*101325);
fplot(pv_1,[20,194.6],'color','r') %presión de vapor
fplot(p_aire_1,[20,194.6],'color','b') %presión de aire
p1=@(t) pv_1(t)+p_aire_1(t);
fplot(p1,[20,194.6],'color','k') %presión total
pv_2=@(t) 5.56*8.31*(t+273.15)/(0.0157*101325);
p_aire_2=@(t) 0.65*8.31*(273.15+t)/(0.0157*101325);
fplot(pv_2,[194.6,300],'color','r') %presión de vapor
fplot(p_aire_2,[194.6,300],'color','b') %presión de aire
p2=@(t) pv_2(t)+p_aire_2(t);
fplot(p2,[194.6,300],'color','k') %presión total
line([194.6,194.6],[0,20],'lineStyle','--')
hold off
grid on
xlabel('T')
ylabel('p_v, p_{aire} (atm)')
title('Presiones de vapor, aire y total')
Movimiento de la bala
Figura 4, se libera el pasador y la bala se puede mover sin fricción a lo largo del tubo
Esta presión es mucho mayor que la atmosférica, por eso, cuando se suelte el pasador, la bala del cañón comenzará a acelerarse hacia la derecha. El proceso de expansión es muy rápido supondremos que es un adiabático, pVγ=cte. Las presiones parciales y la total de la cámara cuando la bala está a distancia x será
Para x=L=1 m, la presión total es p(L)=7.01 atm
La fuerza sobre la bala cuando se encuentra a una distancia x, es (p-patm)π(d/2)2
La ecuación del movimiento
Integramos
Si solamente tuviésemos en cuenta la fuerza que ejerce la presión de vapor
Un valor similar
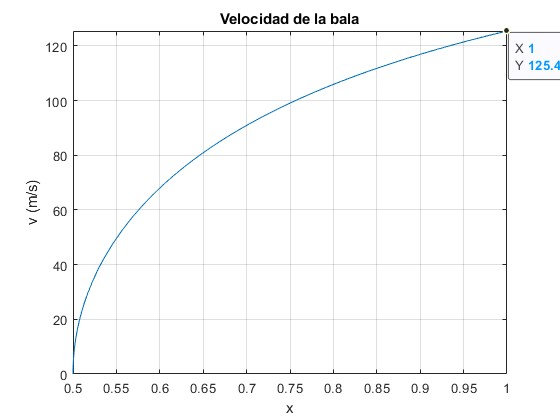
Representamos la velocidad de la bala v en función de su posición x en el tubo en el intervalo 0.5 (parte del reposo) a 1 m
f=@(x) -6.7e5*x.^-0.324/0.324-3.85e4*x.^-0.4/0.4-101325*x;
v=@(x) 0.1*sqrt(pi*(f(x)-f(0.5)));
fplot(v,[0.5,1])
grid on
xlabel('x')
ylabel('v (m/s)')
title('Velocidad de la bala')
Resolvemos por el procedimiento numérico
con las condiciones iniciales, para t=0, x=0.5 m, dx/dt=0 (parte del reposo)
function canon_5
opts=odeset('events',@stop_planeta);
f=@(t, x) [x(2);(6.7e5/x(1)^1.324+3.85e4/x(1)^1.4-101325)*pi*0.01/2];
[t,x]=ode45(f,[0,1],[0.5,0],opts);
plot(t,x(:,1))
grid on
xlabel('t(s)')
ylabel('x (m)')
title('Posición de la bala')
disp([t(end),x(end,2)])
function [value,isterminal,direction]=stop_planeta(~,x)
value=x(1)-1;
isterminal=1;
direction=1;
end
end
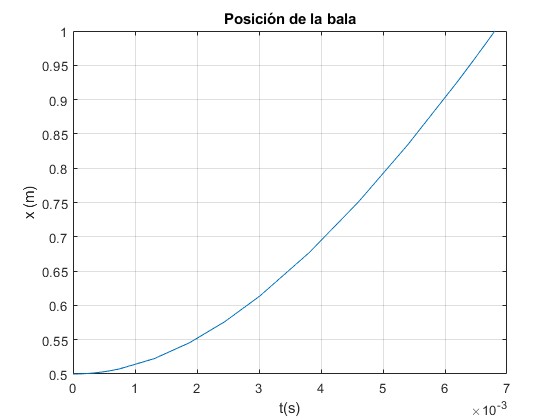
0.0068 125.4270
El tiempo que tarda la bala en salir del cañón x=1 m, es t=0.0068 s, alcanzando una velocidad de 125.4 m/s, que ya hemos calculado previamente
Calor suministrado al sistema
Calculamos el calor total empleado para aumentar la temperatura de T1=20 °C a T4=300 °C
Supondremos que, aunque la evaporación es gradual, toda el agua permanece líquida hasta T3=195 °C. Supondremos también que el aire y el vapor experimentan procesos a volumen constante.
Calentamiento de una masa de hierro mt+mb=22 kg de T1 a T4
Calentamiento de una masa de aire maire=0.65·0.029=0.0189 kg de de T1 a T4
Calentamiento de una masa de agua ma=0.1 kg desde T1 a T4
Calentamiento de una masa de vapor mv=0.1 kg desde T3 a T4
Vaporización de una masa de agua ma=0.1 kg
QFe=(mt+mb)cFe(T4-T1)=22·450(300-20)=2772 kJ
Qaire=maire·caire(T4-T1)=0.65·0.029·720(300-20)=3.8 kJ
Aunque la evaporación es gradual, como aproximación, supondremos que toda el agua permanece líquida hasta T3
Qa=ma·ca(T3-T1)=0.1·4180(195-20)=73.2 kJ
Qv=mv·cv(T3-T3)=0.1·1410(300-195)=14.8 kJ
QL=ma·L=0.1·2.22·106=222 kJ
El calor total necesario para llevar el sistema hasta desde T1 a T4
Q=QFe+Qaire+Qa+QL=3086 kJ
La fuente de calor ha estado encendida un tiempo t=Q/k=3086/5=10.3 min
Referencias
Problemas de las Olimpiadas Nacionales. Problema 1.-Architronito de Arquímedes. OEF 2023 (Lugo)

