Calor latente de vaporización del agua
Para medir el calor de vaporización se coloca un recipiente metálico con una masa m de agua sobre un hornillo eléctrico de potencia P.
La temperatura inicial del agua es Ta. A medida que transcurre el tiempo, se va elevando la temperatura del agua, hasta que entra en ebullición a 100 ºC. Anotamos el tiempo t1.
El agua se evapora, disminuyendo el nivel de agua en el recipiente hasta que toda el agua se ha convertido en vapor. Anotamos el tiempo t2 que transcurre desde el comienzo de la ebullición hasta que se consume el agua.
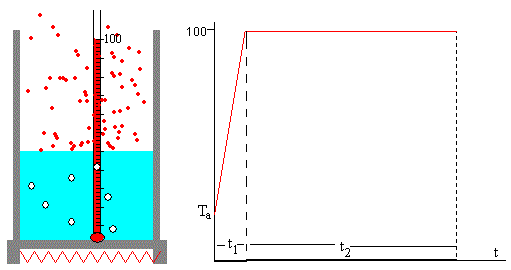
Tendremos las siguientes relaciones
P·t1=m·c·(100-Ta)
P·t2=m·Lv
donde Lv es el calor de evaporación del agua que trataremos de determinar,
Eliminamos la cantidad desconocida P en el sistema de dos ecuaciones, y despejamos Lv.
La medida del calor latente de evaporación del agua es problemática, ya que es difícil determinar el momento en el que el agua entra en ebullición y el momento en el que el agua se evapora completamente.
Las pérdidas de calor son importantes (ley de enfriamiento de Newton) ya que la diferencias de temperatura entre el agua en ebullición y el ambiente es muy grande. Habría que tener en cuenta también, el calor absorbido por el recipiente, el agua que se evapora durante el proceso de calentamiento y el agua que se condensa en las paredes del recipiente.
Actividades
Para
evitar una excesiva complejidad en la simulación de la experiencia, se ha
supuesto que las pérdidas de calor
son despreciables.
Como en una experiencia real, solamente una parte de la energía suministrada
por el
hornillo eléctrico, sobre el que se pone el recipiente de agua, se emplea en
calentarla, el resto va a la atmósfera. La potencia efectiva empleada en el
calentamiento es igual a la potencia consumida menos una proporción
seleccionada aleatoriamente y comprendida entre el 10% y el 30%.
Se introduce
-
La potencia del calentador eléctrico en W, en el control titulado Potencia.
Masa m de agua en gramos en el recipiente, en el control titulado Masa agua.
Temperatura inicial Ta del agua, en el control titulado Temperatura inicial.
Se pulsa el botón titulado Nuevo
Se observa como la temperatura del agua se va incrementando con el tiempo hasta que en el instante t1 el agua empieza a hervir. A partir de ese momento, el agua se va evaporando a la temperatura constante de 100ºC, empleando un tiempo t2 en dicho proceso.
Se miden los tiempos t1 y t2.
Ejemplo:
- Potencia 1000 W
- Masa de agua: m=200 g
- Temperatura inicial, y Ta=20ºC
-
El agua alcanza la temperatura de 100º C en el instante t=78 s.
-
El agua se ha evaporado completamente en el instante t=604 s
Tenemos que t1=78s y t2=604-78=526 s
La potencia efectiva P del hornillo eléctrico que se ha empleado en calentar y evaporar el agua es algo menos de 1000 W.
La temperatura de ebullición del agua y la altura de las montañas
Se produce la ebullición cuando la presión de vapor del agua Pv se iguala a la presión atmosférica del lugar p. La presión de vapor crece rápidamente con la temperatura
A nivel del mar la presión atmosférica es p0 y la temperatura de ebullición del agua es 373 K (100 °C). En la cima de una montaña, la presión atmosférica es más pequeña y la temperatura de ebullición del agua es menor
En el modelo de atmósfera isoterma, la presión atmosférica p disminuye exponencialmente con la altura y, manteniéndose la temperatura T constante
Donde p0 es la presión atmosférica a nivel del mar y H es una constante para una temperatura constante T=293 K (20 °C)
Una forma de la ecuación de Clausius-Clapeyron es
Donde T es la temperatura, L=2255·103 J/kg es el calor latente de ebullición del agua y ΔV es el cambio de volumen específico entre la fase líquida y la fase vapor. Supondremos que L es constante y ΔV≈v el volumen específico (volumen/masa, m3/kg) del vapor que es mucho mayor que la del líquido
Para un mol de vapor, suponiendo que es un gas ideal, PvvM=RT. Donde M=18/1000 kg para el agua
Separando las variables e integrando
T0=373 K (100 °C) es la temperatura de ebullición del agua a nivel del mar donde la presión es p001 atm=1.013·105 N/m2. T=273+t, t es la temperatura de ebullición del agua en grados centígrados a la altura y donde la presión es p. Combinando ambas ecuaciones
Representamos la altura y en función de la temperatura de ebullición t en grados centígrados. Intercambiamos los ejes X e Y para relacionar la temperatura t de ebullición del agua con la altura y
y=@(t) 1.1218e5*(100-t)./(273+t);
fplot(y,[84,100])
grid on
xlabel('t ºC')
ylabel('y (m)')
title('Temperatura de ebullición del agua')
view([90 -90])
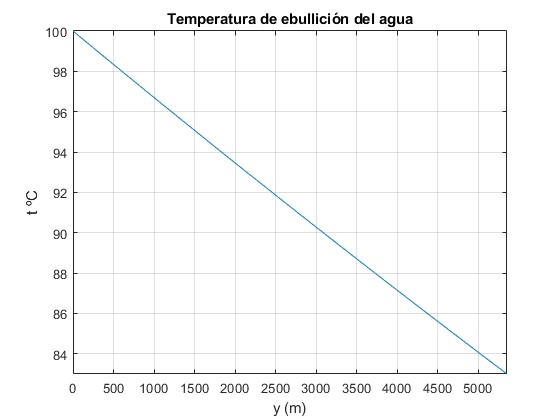
La temperatura de ebullición del agua disminuye con la altura, de una forma casi lineal
Referencias
Güemez, Fiolhais C., Fiolhais M. Revisiting Black's experiments on the latent heats of water. The Physics Teacher Vol 40, January 2002, pp. 26-31
Juan P. Negret. Boiling Water and the Height of Mountains. The Physics Teacher. May 1986, pp. 290-292

