Modelos atómicos de Bohr y Sommerfeld
Modelo atómico de Bohr
Un átomo tiene una dimensión del orden de 10-9 m. Está compuesto por un núcleo relativamente pesado (cuyas dimensiones son del orden de 10-14 m) alrededor del cual se mueven los electrones, cada uno de carga -e (1.6 10-19 C) y masa me (9.1·10-31 kg).
El núcleo está compuesto por protones y neutrones. El número Z de protones coincide con el número de electrones en un átomo neutro. La masa de un protón o de un neutrón es aproximadamente 1850 veces la de un electrón. En consecuencia, la masa de un átomo es prácticamente igual a la del núcleo.
Sin embargo, los electrones de un átomo son los responsables de la mayoría de las propiedades atómicas que se reflejan en las propiedades macroscópicas de la materia.
El movimiento de los electrones alrededor del núcleo se explica, considerando solamente las interacciones entre el núcleo y los electrones (la interacción gravitatoria es completamente despreciable).
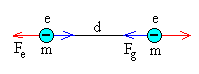
Consideremos dos electrones separados una distancia d, y comparemos la fuerza de repulsión eléctrica con fuerza de atracción entre sus masas.
La intensidad de la interacción gravitatoria es despreciable frente a la interacción electromagnética.
El modelo de Bohr es muy simple y recuerda al modelo planetario de Copérnico, los planetas describiendo órbitas circulares alrededor del Sol. El electrón de un átomo o ión hidrogenoide describe también órbitas circulares, pero los radios de estas órbitas no pueden tener cualquier valor.
Consideremos un átomo o ión con un solo electrón. Supondremos que el núcleo de carga Ze es un centro fijo de fuerzas.
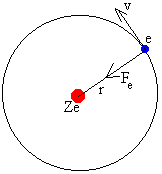
Si el electrón describe una órbita circular de radio r, por la dinámica del movimiento circular uniforme
En el modelo de Bohr, solamente están permitidas aquellas órbitas cuyo momento angular está cuantizado.
n es un número entero que se denomina número cuántico, y h= 6.6256·10-34 Js es la constante de Planck
Esta regla admite otra interpretación
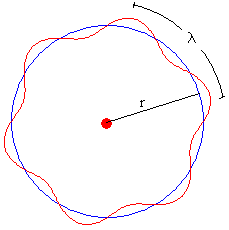
Para que la órbita corresponda a un estado estacionario, la longitud de la circunferencia de radio r deberá ser un múltiplo entero de la longitud de onda λ tal como se ve en la figura.
2πr=nλ
La longitud de onda de de Broglie de una partícula de masa me que se mueve con velocidad v es onda λ=h/p. Donde h es la constante de Planck y p=mev es el momento lineal del electrón.
Los radios de las órbitas permitidas son
donde a0 se denomina radio de Bohr. a0 es el radio de la órbita del electrón del átomo de Hidrógeno Z=1 en su estado fundamental n=1.
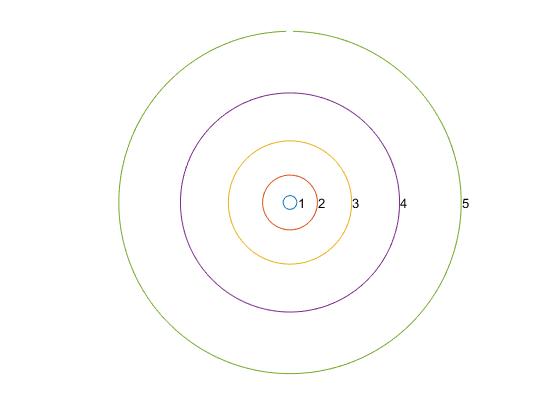
Dibujamos las posibles órbitas circulares del electrón del átomo de hidrógeno, en unidades del radio de Bohr a0
hold on
for n=1:5
fplot(@(t) n^2*cos(t),@(t) n^2*sin(t),[0,2*pi])
text(n^2+0.1, 0,num2str(n))
end
hold off
axis equal
axis off
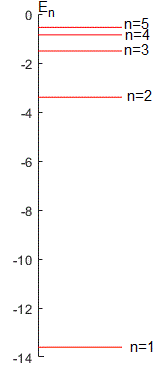
La energía total es
En una órbita circular, la energía total E es la mitad de la energía potencial
La energía del electrón aumenta con el número cuántico n.
La primera energía de excitación es la que lleva a un átomo de su estado fundamental a su primer (o más bajo) estado excitado. La energía del estado fundamental se obtiene con n=1, E1= -13.6 eV y la del primer estado excitado con n=2, E2=-3.4 eV. Las energías se suelen expresar en electrón-voltios (1eV=1.6 10-19 J)
La frecuencia f de la radiación emitida cuando el electrón pasa del estado excitado E2 al fundamental E1 es
Modelo atómico de Sommerfeld
Vamos a derivar la ecuación de las órbitas elípticas permitidas a partir de la formulación Lagrangiana, en vez de integrar la ecuación de la energía, teniendo en cuenta la constancia del momento angular, propiedades de la fuerza de atracción (central y conservativa)
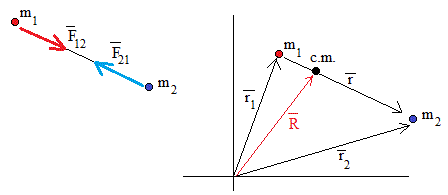
Sean dos partículas de masas m1 y m2 cuyas posiciones respecto de un sistema de Referencia inercial centrado en O son y , respectivamente .
La Lagrangiana L del sistema aislado de dos partículas es
Siendo , la distancia entre las dos partículas
Los dos primeros términos son las energías cinéticas de las dos partículas y el tercer término es la energía potencial de interacción entre las dos partículas
La energía potencial Ep(r) es función únicamente de esta distancia r. Para un átomo o ión hidrogenoide con un núcleo de Z protones y un electrón es
Situamos el origen del Sistema de Referencia en el centro de masas
La Lagrangiana se convierte en
El primer término es la energía cinética de una partícula de masa reducida μ.
En coordenadas polares se expresa
Ecuación del movimiento
Las ecuaciones del movimiento son
En la dirección radial
Angular
Se conserva una cantidad que denominamos l, momento angular
En un sistema aislado de dos partículas interactuantes, la energía permanece constante
Ecuación de la trayectoria
Despejamos la componente radial de la velocidad dr/dt y después, obtenemos la ecuación de la trayectoria
En el caso de un átomo o ión hidrogenoide con un solo electrón la energía potencial es Ep(r)=-κ/r
Para integrar, llamamos u=1/r, du=-dr/r2
Tenemos que resolver una integral del tipo
Efectuamos un nuevo cambio de variable, z=u-b, dz=du
Donde C es una constante de integración que determinaremos más adelante
Deshacemos los cambios
Tomando C=-π/2, sin(θ-π/2)=-cos(θ),
La trayectoria es una elipse con ε<1. La energía E es negativa
Tomando el valor de la constante C=-π/2, establecemos el origen de ángulos, el ángulo θ=0, cuando la distancia r es mínima
Geometría de la elipse
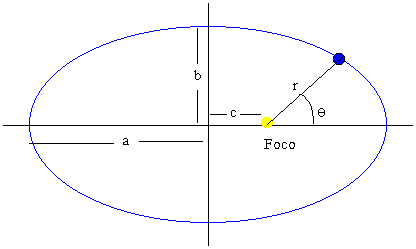
El eje mayor 2a de la elipse es la suma de la distancia mínima (θ=0) y máxima (θ=π) al centro de fuerzas situado en el foco de la elipse
La excentricidad de la elipse es el cociente ε=c/a
La semidistancia focal c es
El semieje menor b es
Sabiendo que el parámetro d=b2/a, otra forma de expresar la ecuación de la elipse es
La energía E de la partícula solamente depende del semieje mayor a de la elipse
Reglas de cuantización
Angular
Radial
Resolvemos la integral. Sea
Integramos por partes
En el numerador, sumamos y restamos la unidad
Llegamos a este resultado
Pra resolver la integral, hacemos el cambio de variable
Utilizamos las relaciones trigonométricas
Integramos respecto de x ente los límites 0 e ∞
El resultado final es
Niveles de energía
En el apartado anterior, hemos obtenido los siguientes resultados
Para nr=0, la órbita es circular
Niveles de energía
Donde q=e es la carga del electrón. La masa del núcleo es mucho mayor que la masa del electrón por lo que μ≈me. Obtenemos la fórmula de Bohr con n=nr+nθ
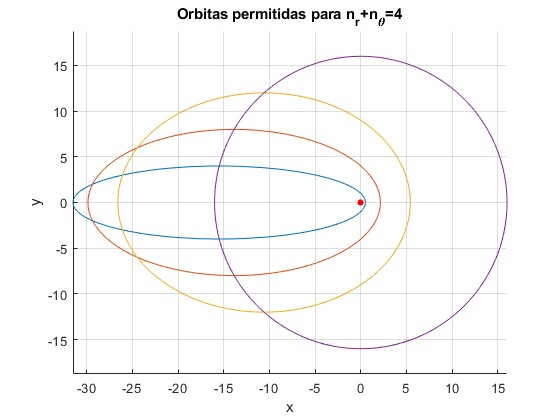
Orbitas para nr+nθ=4
El semeje mayor de la elipse a vale
La ecuación de la elipse es
Expresamos la ecuación de la elipse en términos de los números nr y nθ
Representamos las órbitas permitidas para nr+nθ=4. El punto de color rojo, representa el centro de masas. La órbita circular corresponde a nr=0, nθ=4
n=4;
hold on
for n_t=1:n
r=@(x) n_t^2./(1+sqrt(1-n_t^2/n^2)*cos(x));
fplot(@(x) r(x).*cos(x), @(x) r(x).*sin(x),[0,2*pi])
end
plot(0,0,'ro','markersize',4,'markerfacecolor','r') %núcleo
hold off
grid on
axis equal
xlabel('x')
ylabel('y')
title('Orbitas permitidas para n_r+n_\theta=4')
Referencias
Blomm D., Blomm D. W. Vibrating wire loop and the Bohr model. The Physics Teacher, 41, May 2003, pp. 292-294
Wilder R. Cardoso, Mariana C. Nakagaki. Revisiting Sommerfeld’s atomic model using Euler–Lagrange dynamics. Am. J. Phys. 92 (11), November 2024. pp. 872-877

