Expansión de una gas. Proceso reversible e irreversible
Choque de una molécula contra un émbolo móvil
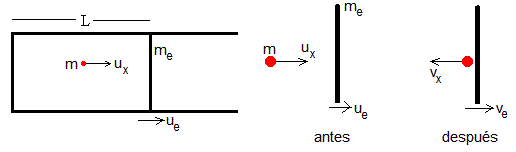
Una partícula de masa m y velocidad ux choca elásticamente con un émbolo de masa me que se mueve con velocidad ue
Conservación del momento lineal y la igualdad de la energía cinética antes y después del choque
Escribimos las dos ecuaciones en la forma equivalente
Despejando las incógnitas
Como la masa me del émbolo es muy grande comparado con masa m de la partícula
El émbolo no cambia apenas de velocidad como resultado del choque con las moléculas ya que su masa me es muy grande comparada con la masa m de una molécula. Sin embargo, como el número de choques es muy grande, para que el émbolo se mantenga con velocidad constante es necesario ejercer una fuerza.
Supongamos que el gas consiste en N partículas contenidas en el volumen cilíndrico V=AL, de longitud L y sección A, tal como se muestra en la figura. El émbolo se mueve con velocidad ue. El número de colisiones de las moléculas con velocidad ux≥ue con el émbolo en el tiempo Δt es
Las moléculas con velocidad ux<ue no alcanzan el émbolo
La variación de energía cinética que experimenta el gas en cada choque con el émbolo es
La variación de energía que experimenta el gas en la unidad de tiempo debido a las moléculas con velocidad ux
En la página titulada La ley de distribución de las velocidades moleculares, calculamos el número de moléculas cuya componente X de la velocidad está comprendida entre ux, ux+dux independientemente de los valores de las otras dos componentes, integrando respecto de uy y uz entre los límites -∞ y +∞.
Relación entre temperatura T y volumen V del gas
La variación de energía que experimenta el gas en la unidad de tiempo debido a todas las moléculas con velocidad ux≥ue es
Es muy útil escribir esta ecuación en términos de dos parámetros adimensionales α y β
El término que multiplica a ambos parámetros es la velocidad vrms
Relacionamos el cambio de volumen dV con el intervalo de tiempo dt sabiendo que el émbolo se mueve con velocidad constante ue
x0 es la posición inicial del émbolo. Por otra parte, el producto mN es la masa de las moléculas del gas que es el producto del número de moles n por el peso molecular M
Aunque el gas no está en equilibrio, supondremos que es válida la relación dU=n·cvdT. Su justificación se explica en el primer artículo citado en las referencias
Teniendo en cuenta que NAk=R. NA=6.0225·1023 mol-1 es el número de Avogadro y R=8.3143 J/(K·mol) es la constante de los gases. Por otra parte, el peso molecular M=NA·m, siendo m la masa de una molécula. La expresión anterior nos proporciona una relación entre el volumen y la temperatura del gas
Integramos la ecuación diferencial, sabiendo que la temperatura inicial es T0 y la final T. El volumen inicial V0 y el final V
El parámetro r
En general, el parámetro r se ha de evaluar numéricamente, dado el valor de β o de la velocidad del émbolo ue
Cuando la velocidad del émbolo es muy pequeña ue→0, entonces β→0. Utilizando el valor de la integral
>> syms x;
>> syms a positive
>> int('x^2*exp(-a*x^2)',x,0,inf)
ans =pi^(1/2)/(4*a^(3/2))
Obtenemos r=1, que corresponde a una transformación adiabática
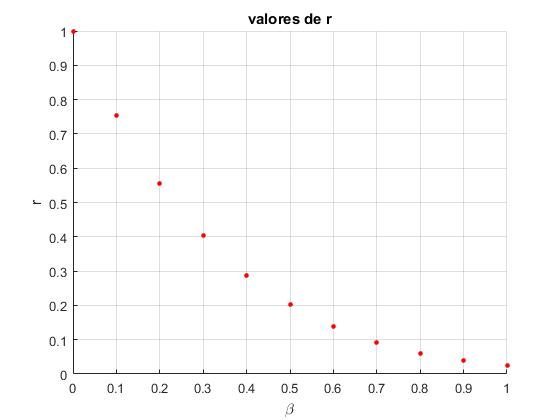
Para β=1, la velocidad del émbolo ue iguala a la velocidad media de las moléculas vrms, el resultado de r es próximo a cero, ya que una gran parte de las moléculas del gas tiene una velocidad ux más pequeña que el émbolo ue
beta=1; f=@(x) ((x-beta).^2).*exp(-3*x.^2/2); r=3*sqrt(6/pi)*integral(f,beta,inf); disp(r)
0.0247
Calculamos y representamos r para algunos valores de β en el intervalo [0,1]
hold on
for beta=0:0.1:1
f=@(x) ((x-beta).^2).*exp(-3*x.^2/2);
r=3*sqrt(6/pi)*integral(f,beta,inf);
plot(beta,r,'ro','markersize',3,'markeredgecolor','r','markerfacecolor','r')
end
hold off
grid on
xlabel('\beta')
ylabel('r')
title('valores de r')
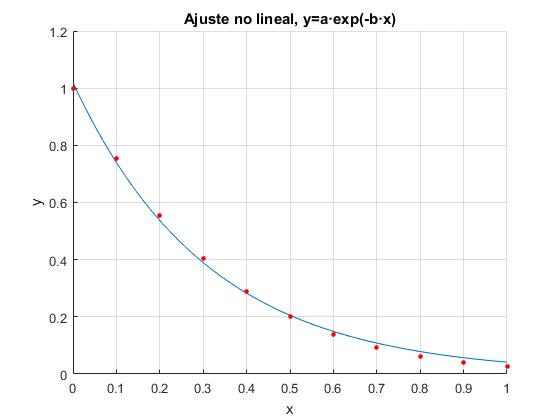
Ajustamos estos datos a una exponencial decreciente, y=a·exp(-b·x)
i=1;
x=0:0.1:1;
y=zeros(1,length(x));
for beta=x
f1=@(x) ((x-beta).^2).*exp(-3*x.^2/2);
y(i)=3*sqrt(6/pi)*integral(f1,beta,inf);
i=i+1;
end
f=@(a,x) a(1)*exp(-a(2)*x);
error=@(a) sum((y-f(a,x)).^2);
a0=[1,3.2]; %valor inicial
af=fminsearch(error,a0);
g=@(x) f(af,x);
hold on
fplot(g,[x(1),x(end)])
plot(x,y,'ro','markersize',3,'markeredgecolor','r','markerfacecolor','r')
title('Ajuste no lineal, y=a·exp(-b·x)')
xlabel('x')
ylabel('y')
grid on
af = 1.0191 3.2041
El parámetro a=1 y b=3.2. Podríamos utilizar esta función exponencial para calcular el valor de r para un valor dado de β, en vez de realizar la integración numérica
Referencias
E N Miranda What lies between a free adiabatic expansion and a quasi-static one? . Eur. J. Phys. 29 (2008), pp. 937-943

