Distribución de la energía entre las moléculas de un gas ideal
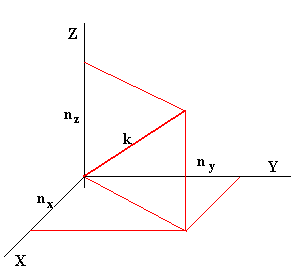
La energía de una partícula de masa m que se mueve en una región unidimensional de anchura a no puede tener cualquier valor. Cuando resolvemos la ecuación de Schrödinger para una partícula que se mueve en cubo de anchura a obtenemos los niveles de energía que puede ocupar dicha partícula.
siendo nx, ny, y nz números enteros positivos.
Cuando a es grande, como ocurre para las partículas de un gas encerrado en un recipiente, los niveles de energía están muy juntos. Nuestra tarea ahora es la de calcular el número de niveles de energía comprendidos en el intervalo entre E y E+dE.
Primero, calculamos el número de niveles en el intervalo entre 0 y E, que es igual a la octava parte del volumen de una esfera de radio k, tal como puede verse en la figura, ya que nx, ny, y nz son números enteros positivos.
Siendo V el volumen del recipiente V=a3.
Derivando con respecto de E, obtenemos el número de niveles comprendidos entre E y E+dE.
El número de moléculas cuya energía está comprendida entre E y E+dE se obtiene aplicando la ley de Boltzmann.
N es el número total de partículas en el recipiente de volumen V y C es una constante de proporcionalidad que se determina a partir de la condición de que todas las partículas tienen una energía comprendida entre cero e infinito.
Como la energía de las moléculas es solamente cinética
La integral se convierte en
Teniendo en cuenta el resultado de la integral
>> syms x;
>> syms a positive
>> int('x^2*exp(-a*x^2)',x,0,inf)
ans =pi^(1/2)/(4*a^(3/2))
El valor de la constante C de proporcionalidad es
Introduciendo el valor de C en la fórmula anterior, queda finalmente.
Hacemos el cambio de variable x=E/(kT)
Representamos (1/N)·dn/dx mediante la función ezplot en el intervalo 0 a 4.
>> syms x;
>> y=2*x^(1/2)*exp(-x)/sym('pi')^(1/2);
>> ezplot(y,[0,4])
>> xlabel('x')
>> ylabel('dn/dx')
>> title('Distribución de la energía entre las moléculas')
>> grid on
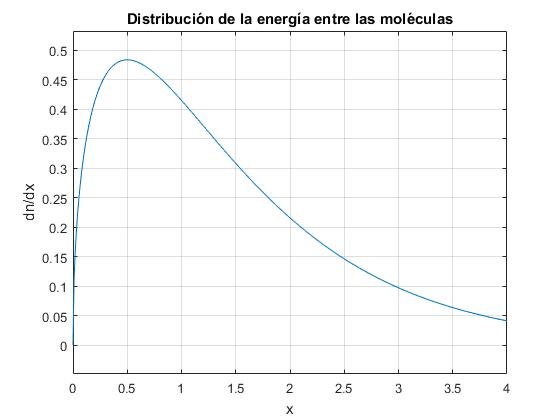
La función de distribución presenta un máximo para x=1/2. Para la energía E=(kT)/2;
>> syms x;
>> y=2*x^(1/2)*exp(-x)/sym('pi')^(1/2);
>> yp=diff(y);
>> solve(yp)
ans =1/2
Número de partículas que tienen una energía menor que Ec
Calculamos el número de partículas que tienen una energía menor que Ec
Llamando x=E/kT
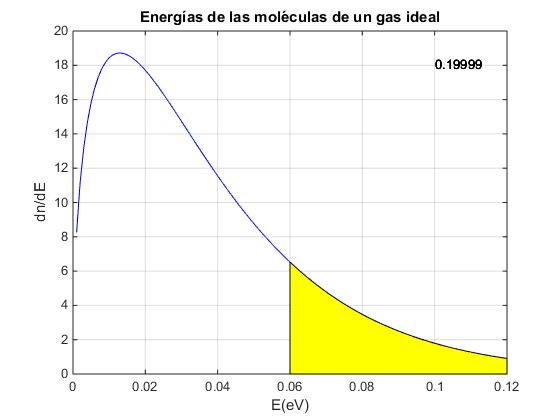
Calcular la proporción de moléculas de un gas ideal N1/N a la temperatura T=300 K cuyas energías son menores que Ec=0.06 eV. Datos: 1eV=1.6·10-19 J, la constante de Boltzmann k=1.38·10-23 J/K.
>> syms x xc;
>> y=2*x^(1/2)*exp(-x)/sym('pi')^(1/2);
>> p=int(y,0,xc)
p = 1 - (2*xc^(1/2))/(pi^(1/2)*exp(xc)) - erfc(xc^(1/2))
>> subs(p,xc,2.3188)
ans = 0.7997
La proporción de partículas cuya energía es mayor que Ec=0.06 eV es 1-N1/N=1-0.997=0.2003.
Hacemos el mismo cálculo pero en téminos de la función error, erf. Se hace el cambio de variable y2=x
Se integra por partes
>> syms x xc;
>> int('x^(1/2)*exp(-x)',x,0,xc)
ans =(pi^(1/2)*erf(xc^(1/2)))/2 - xc^(1/2)*exp(-xc)
erf(x) se denomina integral de los errores y viene tabulada en los libros de Matemáticas.
La proporción de partículas cuya energía está comprendida entre 0 y Ec es
Calculamos la proporción de partículas cuya energía es menor que Ec=0.06 eV a la temperatura T=300 K y obtenemos el mismo resultado
>> xc=0.06*1.6e-19/(1.38e-23*300); >> p=erf(sqrt(xc))-2*sqrt(xc)*exp(-xc)/sqrt(pi) p = 0.7997
Los datos experimentales están de acuerdo con la teoría, lo que confirma la aplicabilidad de la estadística de Maxwell-Boltzmann. Por ejemplo, una reacción determinada ocurre solamente si las moléculas tienen cierta energía igual o mayor que Ec. La velocidad de la reacción a una temperatura dada depende entonces, del número de moléculas que tienen una energía mayor o igual que Ec.
Se representa la función dn/dE y se calcula la proporción de moléculas cuya energía es superior a una dada, es decir, el cociente entre el área sombreada y el área total bajo la curva.
T=300; %temperatura
Ec=0.06; %energía en eV
xc=Ec*11604.49/T;
%proporción de partículas con E>Ec
pr=1-2*(sqrt(pi)*erf(sqrt(xc))/2-sqrt(xc)*exp(-xc))/sqrt(pi);
f=@(x) 2*sqrt(x).*exp(-11604.49*x/T)*1250083.9/(sqrt(pi)*T^(3/2));
E=(0.1:0.1:12)/100;
y=f(E);
hold on
plot(E,y, 'b')
xx=[Ec Ec E(E>Ec & E<0.12) 0.12 0.12];
yy=[0 f(Ec) y(E>Ec & E<0.12) f(0.12) 0];
fill(xx,yy,'y'); %rellena un área de color especificado
text(0.1,18,num2str(pr));
hold off
grid on
xlabel('E(eV)')
ylabel('dn/dE')
title('Energías de las moléculas de un gas ideal')
Energía interna
Hallamos la energía del gas ideal mediante
Teniendo en cuenta el resultado de la integral
>> syms x;
>> syms a positive
>> int('x^4*exp(-a*x^2)',x,0,inf)
ans =(3*pi^(1/2))/(8*a^(5/2))
Legamos a la expresión
Dividiendo entre N, número de moléculas, obtenemos la energía media de las moléculas es 3kT/2
Por tanto, la energía de las moléculas de un gas ideal monoatómico es proporcional a la temperatura absoluta del gas. Históricamente esta ecuación fue introducida en el siglo XIX mucho antes del desarrollo de la Mecánica Estadística, en conexión con la teoría cinética de los gases.
El número N de moléculas es igual al número de moles μ por el número de Avogadro N0=6.0225 1023 mol-1. El producto del número de Avogadro por la constante de Boltzmann k=1.38 10-23 J/K nos da la constante R=8.3143 J/(K mol) de los gases ideales.

