La estructura atómica
La experiencia de Rutherford fue crucial en la determinación de la estructura atómica. Los párrafos que siguen son un extracto de su propia comunicación (1911):
"Es un hecho bien conocido que las partículas alfa y beta sufren desviaciones de sus trayectorias rectilíneas a causa de las interacciones con los átomos de la materia.
Parece indudable que estas partículas de movimiento veloz pasan en su recorrido a través de los átomos y las desviaciones observadas son debidas al campo eléctrico dentro del sistema atómico.
Las observaciones de Geiger y Mardsen sobre la dispersión de partículas alfa, indican que algunas de estas partículas deben de experimentar en un solo encuentro desviaciones superiores a un ángulo recto.
Un cálculo simple demuestra que el átomo debe de ser asiento de un intenso campo eléctrico para que se produzca una gran desviación en una colisión simple..."
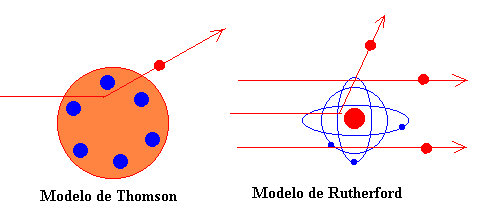
En aquella época Thomson había elaborado un modelo de átomo consistente en un cierto número N de corpúsculos cargados negativamente, acompañados de una cantidad igual de electricidad positiva distribuida uniformemente en toda una esfera. Rutherford pone a prueba este modelo y sugiere el actual modelo de átomo.
"La teoría de Thomson está basada en la hipótesis de que la dispersión debida a un simple choque atómico es pequeña y que la estructura supuesta para el átomo no admite una desviación muy grande de una partícula alfa que incida sobre el mismo, a menos que se suponga que el diámetro de la esfera de electricidad positiva es pequeño en comparación con el diámetro de influencia del átomo. Puesto que las partículas alfa y beta atraviesan el átomo, un estudio riguroso de la naturaleza de la desviación debe proporcionar cierta luz sobre la constitución del átomo, capaz de producir los efectos observados. En efecto, la dispersión de partículas cargadas de alta velocidad por los átomos de la materia constituyen uno de los métodos más prometedores de ataque del problema.."
Sección eficaz para la dispersión
Como hemos visto al estudiar el fenómeno de la dispersión, la interacción entre partículas cargadas positivamente corresponde a una fuerza central y conservativa. La energía total es siempre positiva por lo que la trayectoria es una hipérbola.
Se denomina parámetro de impacto a la distancia existente entre la dirección de la partícula incidente y el centro de fuerzas.
Una vez que la partícula ha sido dispersada por el núcleo se aleja del centro de fuerzas siguiendo una trayectoria que tiende asintóticamente a una línea recta. El ángulo Φ que forma dicha recta con el eje horizontal se denomina ángulo de dispersión.
La fórmula que relaciona el parámetro de impacto b con el ángulo de dispersión Φ para una energía E dada de la partícula alfa, es la siguiente.
Consideremos un haz uniforme de partículas cargadas, todas con la misma masa y energía que inciden sobre un centro de fuerzas, por ejemplo, un núcleo de una muestra metálica
El haz incidente está caracterizado por su intensidad I, que mide el número de partículas que atraviesan el área normal al haz en la unidad de tiempo. La dirección final de cada partícula del haz será diferente debido a la dispersión por el núcleo.
Se denomina sección eficaz para la dispersión σ(Φ) al número de partículas dispersadas en el ángulo sólido dΩ por unidad de tiempo, dividido entre la intensidad incidente.
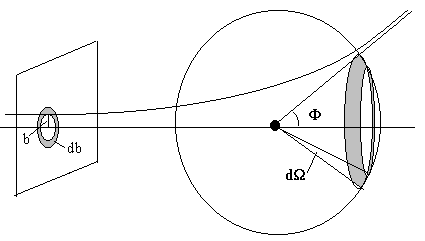
El área sombreada de la esfera tiene un área (2πR·sinΦ)(RdΦ), que corresponde al ángulo sólido dΩ= 2π·sinΦ dΦ.
El número de partículas que inciden sobre el centro dispersor con un parámetro de impacto entre b y b+db es el producto de la intensidad I por el área del anillo que se muestra a la izquierda de la figura I·(2πbdb). Dichas partículas cambiarán su dirección debido a la dispersión, estando su ángulo de desviación comprendido entre Φ y Φ+dΦ. Luego,
El signo menos significa que a un incremento del parámetro de impacto b, le corresponde a una disminución del ángulo de dispersión Φ.
Simplificamos la intensidad I del haz incidente.
Teniendo en cuenta la relación entre parámetro de impacto b y ángulo de dispersión Φ.
Llagamos a la siguiente relación
Donde Z es el número atómico del blanco, z el número atómico del proyectil, e la carga del electrón, E la energía de la partícula incidente y Φ el ángulo de dispersión
Esta es la famosa fórmula de Rutherford, la sección eficaz diferencial de dispersión, confirmada por las experiencias de Geiger y que dio lugar a un nuevo modelo de átomo, formado por un núcleo muy pequeño cargado positivamente y una región amplia en torno al núcleo en la que se distribuye la carga negativa.
Actividades
Se elige el material del blanco, en el control Material del blanco.
Se introduce
- la energía de la partícula alfa en MeV en el control titulado Energía
Se pulsa el botón titulado Nuevo
Las partículas alfa emitidas por el material radioactivo comiencen a bombardear el blanco.
Al lado del material del blanco elegido, se proporciona el dato de su numero atómico Z. Cuanto mayor sea éste, mayor será la intensidad de la fuerza repulsiva entre el núcleo fijo de dicho elemento y la partícula alfa. Verificar la influencia del número atómico en el experimento de dispersión, manteniendo constante la energía de las partículas alfa incidentes.
Experimentar con distintos blancos y energías de las partículas alfa. Observar que son muy raros los sucesos en los que la partícula alfa experimenta una gran desviación.
Este programa interactivo no es una simulación real de la experiencia de Rutherford, solamente trata de explicar los aspectos esenciales de este famosa experiencia. El programa ha sido alterado para mostrar algunos sucesos en los que una partícula alfa resulta desviada, que en la experiencia real son altamente improbables.

