Foco de capacidad calorífica finita
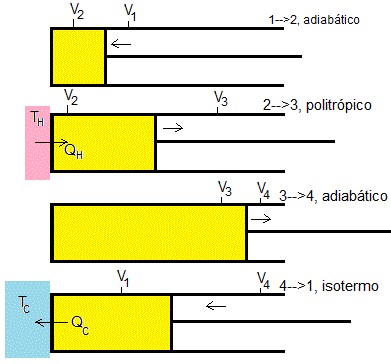
Gas ideal contenido en un recipiente cilíndrico en contacto con un foco de capacidad calorífica finita
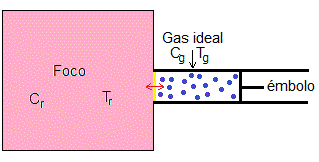
El sistema que estudiamos en este apartado, consiste en un gas ideal a la temperatura Tg y un foco de calor a temperatura Tr. El gas se puede comprimir o expandir mediante un émbolo
El foco de calor tiene tamaño finito y un volumen constante, por lo que su temperatura Tr puede cambiar debido al intercambio de calor con el gas δQr=-δQg. El gas y el foco están en todo momento en equilibrio térmico de modo que Tr=Tg=T.
Para el gas
dUg=δQg-p·dV
- Ug es la energía interna del gas, dUg=n·cv·dT, donde cv es el calor calorífico a volumen constante del gas
- Qg es el calor absorbido por el gas, cedido por el foco
- p·dV es e trabajo realizado
Para el foco de calor
dUr=δQr=Cr·dT
- Cr es la capacidad calorífica del foco cuyo volumen es constante
Supondremos que la capacidad calorífica Cr y el calor específico cv se mantienen constantes durante el proceso
De las realaciones anteriores obtenemos
Integrando
Teniendo en cuenta que el índice adiabático, cp y cv son los calores específicos a presión y volumen constantes del gas ideal
Para el gas ideal contenido en el recipiente cilíndrico, nR=γCg-Cg
La ecuación del proceso politrópico es
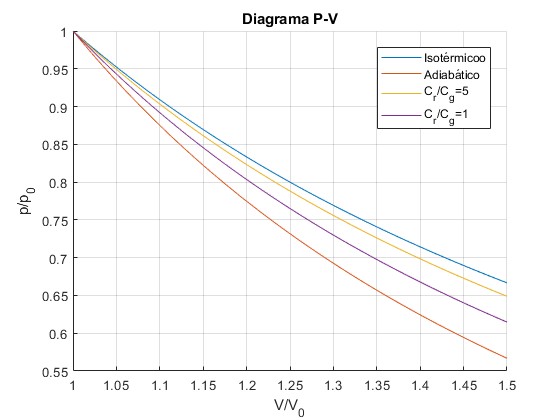
- El proceso isotermo, β=1, se produce cuando Cr→∞ , el foco se hace muy grande y su temperatura permanece constante
- El proceso adiabático, β=γ, se produce cuando Cr→0, el foco se hace muy pequeño y el gas ideal es un sistema aislado
Por tanto, 1≤β≤γ
La ecuación de estado de un gas ideal, pV=nRT
Representamos p/p0 en función de V/V0 para un gas diatómico (γ=1.4), donde p0 y V0 son las presión y volumen iniciales para un determinado proceso
hold on
fplot(@(x) 1./x,[1,1.5]) %isotermo
fplot(@(x) 1./x.^1.4,[1,1.5])%adiabático
beta=(1.4+5)/(1+5);
fplot(@(x) 1./x.^beta,[1,1.5]) %C_r/C_g=5
beta=(1.4+1)/(1+1);
fplot(@(x) 1./x.^beta,[1,1.5]) %C_r/C_g=1
hold off
grid on
xlabel('V/V_0')
ylabel('p/p_0')
legend('Isotérmicoo','Adiabático','C_r/C_g=5','C_r/C_g=1','Location','best')
title('Diagrama P-V')
Donde Cg=ncv es la capacidad calorífica del gas
Representamos β en función del cociente Cr/Cg para γ=1.4
x=logspace(-2,2,100);
y=(1.4+x)./(1+x);
semilogx(x,y)
grid on
xlabel('C_r/C_g')
ylabel('\beta')
title('Indice \beta')
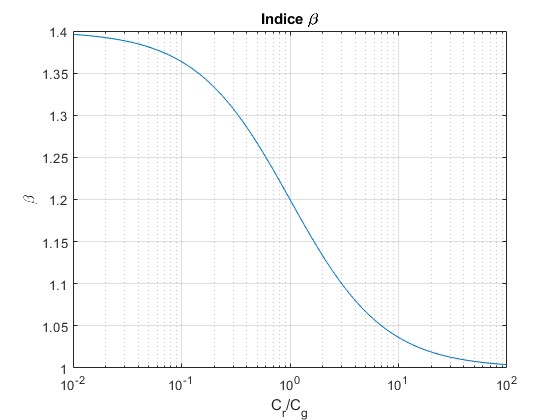
En la gráfica vemos que
- Cr/Cg→0, β→γ, proceso adiabático
- Cr/Cg→∞, β→1, proceso isotermo
Trabajo y calor
El trabajo es
El calor
Ejemplos
En este apartado, calculamos el índice β de un sistema formado por aire (supuesto gas ideal) y un foco finito de calor que podría ser: aire, agua o arena
Aire, aire
- El gas ideal es aire que ocupa 10 l a la temperatura ambiente
- El foco finito es 0.1 l de aire a temperatura ambiente
Aire, agua
- El gas ideal es aire que ocupa 10 l a la temperatura ambiente
- El foco finito es 0.2 l de agua a temperatura ambiente
Aire, arena
- El gas ideal es aire que ocupa 10 l a la temperatura ambiente
- El foco finito es 20 g de arena a temperatura ambiente. Su capacidad calorífica es Cr=20 J/K
Transformación 1-->2 adiabática
El aire es un gas diatómico, calor específico a volumen constante cv=5R/2=5·8.3143/2 J/(K·mol)
El número de moles que contienen 10 l de aire es n=1.29kg/m3·0.01m3/28.84·10-3 kg/mol
La capacidad calorífica de 10 l de aire es Cg=ncv=9.29737≈9.3 J/K.
La capacidad calorífica de 0.1 l de aire es Cr=0.093 J/K
El calor específico del agua es cv=4.186 J/(g·K).
La capacidad calorífica de 200 g de agua es Cr=200·4.186=837.2 J/K
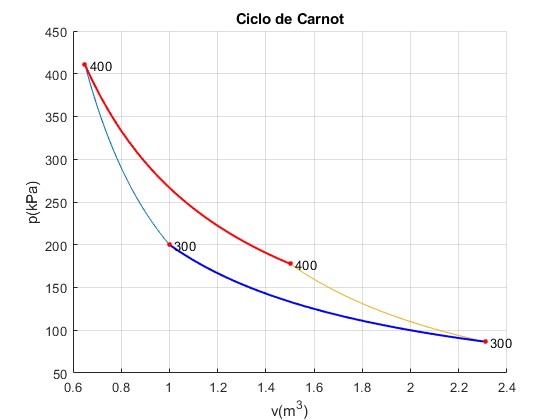
Ciclo de Carnot
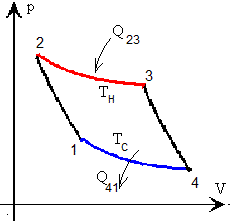
Hemos estudiado el ciclo de Carnot, en este apartado estudiamos el siguiente ejemplo
Los datos iniciales son los que figuran en la tabla adjunta. A partir de estos datos, hemos de rellenar los huecos de la tabla.
| Variables | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Presión p (kPa) | 200 | |||
| Volumen V (m3) | 1 | 1.5 | ||
| Temperatura T (K) | 300 | 400 | 400 | 300 |
La temperatura del foco calientes TH=400 K y la temperatura del foco frío es TC=300 K
Para un gas monoatómico cv=3R/2, cp=5R/2, γ=cp/cv=5/3
La ecuación de estado de un gas ideal es p·V=nR·T. El número de moles
En un proceso adiabático,
En este proceso isotérmico, p·V=cte
Transformación 1-->2, adiabática
Transformación 2-->3, isotérmica a la temperatura TH
Transformación 3-->4, adiabática
Transformación 3-->4, isotérmica a la temperatura TC
Representamos el ciclo de Carnot
En color rojo, línea gruesa, se muestra la transformación 2-->3 cuando el gas está en contacto con el foco caliente. En color azul, línea gruesa, se muestra la transformación 4--->1 cuando el gas está en contacto con el foco frío
%datos
TH=400; % Temperatura del foco caliente
TC=300; %temperatura del foco frío
v1=1; %m^3
v3=1.5;
p1=200e3; %Pa
R=8.3143; %constante de los gases
%gas monoatómico
gamma=5/3; % adibático, 7/5 para el diatómico
nMoles=p1*v1/(R*TC);
%1--->2, adiabático
v2=v1*(TH/TC)^(1/(1-gamma));
p2=nMoles*R*TH/v2;
%2--->3, isotermo
p3=nMoles*R*TH/v3;
%3--->4, adiabática
v4=v3*(TC/TH)^(1/(1-gamma));
p4=nMoles*R*TC/v4;
hold on
fplot(@(v) v, @(v) (p1*(v1./v).^gamma)/1000 ,[v2,v1])
fplot(@(v) v, @(v) (p2*(v2./v))/1000 ,[v2,v3],'color','r','linewidth',1.5)
fplot(@(v) v, @(v) (p3*(v3./v).^gamma)/1000 ,[v3,v4])
fplot(@(v) v, @(v) (p4*v4./v)/1000 ,[v1,v4],'color','b','linewidth',1.5)
plot(v1,p1/1000,'ro','markersize',3,'markerfacecolor','r')
text(v1+0.02,p1/1000,num2str(TC))
plot(v2,p2/1000,'ro','markersize',3,'markerfacecolor','r')
text(v2+0.02,p2/1000,num2str(TH))
plot(v3,p3/1000,'ro','markersize',3,'markerfacecolor','r')
text(v3+0.02,p3/1000,num2str(TH))
plot(v4,p4/1000,'ro','markersize',3,'markerfacecolor','r')
text(v4+0.02,p4/1000,num2str(TC))
hold off
grid on
xlabel('v(m^3)')
ylabel('p(kPa)')
title('Ciclo de Carnot')
Calculamos el trabajo, calor
Transformación 1-->2, adiabática
Transformación 2-->3, isotérmica a la temperatura TH
Transformación 3-->4, adiabática
Transformación 4-->1, isotérmica a la temperatura TC
Q12=0
W12=-n·cv(TH-TC)=-100.00 kJ
Q34=0
W34=-n·cv(TC-TH)=100.00 kJ
Trabajo total, W=W12+W23+W34+W41=55.80 kJ
Calor total, Q=Q23+Q41=55.80 kJ
En un ciclo cerrado la variación de energía interna ΔU=0, por tanto Q=W
Añadimos el siguiente código al script anterior
%trabajo y calor
cV=3*R/2; %calor específico a volumen constante
W_12=-nMoles*cV*(TH-TC); %adiabático
W_23=nMoles*R*TH*log(v3/v2); %isotermo
Q_23=W_23;
W_34=-nMoles*cV*(TC-TH); %adiabático
W_41=nMoles*R*TC*log(v1/v4); %isotermo
Q_41=W_41;
disp('Trabajo');
fprintf('W_12=%2.2f, W_23=%2.2f, W_34=%2.2f, W_41=%2.2f\n', W_12, W_23, W_34, W_41)
disp('Calor');
fprintf('Q_23=%2.2f, Q_41=%2.2f\n', Q_23, Q_41)
disp('Total')
W=W_12+W_23+W_34+W_41;
Q=Q_23+Q_41;
fprintf('Trabajo=%2.2f, Calor =%2.2f\n', W, Q);
Trabajo W_12=-100000.00, W_23=223196.86, W_34=100000.00, W_41=-167397.64 Calor Q_23=223196.86, Q_41=-167397.64 Total Trabajo=55799.21, Calor =55799.21
Ciclo de Carnot con el foco caliente de capacidad calorífica finita
En el apartado anterior, el foco caliente y el foco frío tenían una capacidad calorífica infinita, sus temperaturas no cambiaban cuando la máquina térmica extraía calor del foco caliente y lo cedía al foco frío. En este apartado, supondremos que el foco caliente tiene una capacidad calorífica Cr finita, su temperatura TH va a cambiar cuando el gas intercambia calor. El foco frío tiene una capacidad calorífica infinita por lo que su temperatura TC permanece constante
Como hemos visto en el primer apartado, la transformación 2--->3 (expansión del gas) en contacto con un foco finito se describe mediante un proceso politrópico en vez de un proceso isotérmico
El clásico ciclo de Carnot se sustituye por los siguientes transformaciones
Los datos iniciales son los que figuran en la tabla adjunta. A partir de estos datos, hemos de rellenar los huecos de la tabla.
| Variables | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Presión p (kPa) | 200 | |||
| Volumen V (m3) | 1 | 1.5 | ||
| Temperatura T (K) | 300 | 400 | 300 |
La temperatura inicial del foco finito caliente es T2=400 K y la temperatura del foco frío es TC=300 K
Supondremos que el exponente β=1.0835 bastante próximo a una transformación isotérmica β=1. Conocido β determinamos la capacidad calorífica del foco finito
Ciclo n° 1
Determinamos las incógnitas: presiones, volúmenes y temperaturas de los vértices a partir de los datos de la tabla y las transformaciones
Transformación 1-->2, adiabática
Transformación 2-->3, politrópica
Transformación 3-->4, adiabática
Transformación 4-->1, isotérmica a la temperatura TC
Calculamos el trabajo, calor
Transformación 1-->2, adiabática
Transformación 2-->3, politrópica
Transformación 3-->4, adiabática
Transformación 4-->1, isotérmica a la temperatura TC
Q12=0
W12=-n·cv(T2-TC)=-100.00 kJ
Q34=0
W34=-n·cv(TC-T3)=73.00 kJ
Trabajo total, W=W12+W23+W34+W41=42.14 kJ
Calor total, Q=Q23+Q41=42.14 kJ
En un ciclo cerrado la variación de energía interna ΔU=0, por tanto Q=W
Representamos el ciclo de Carnot. Calculamos el calor y el trabajo en cada transformación.
En color rojo, línea gruesa, se muestra la transformación 2-->3 cuando el gas está en contacto con el foco finito inicialmente caliente. En color azul, línea gruesa, se muestra la transformación 4--->1 cuando el gas está en contacto con el foco frío
%datos
TH=400; % Temperatura del foco finito
TC=300; %temperatura del foco
v1=1; %m^3
v3=1.5;
p1=200e3; %Pa
R=8.3143; %constante de los gases
%gas monoatómico
gamma=5/3; % adibático,
beta=1.0835; %politrópico
nMoles=p1*v1/(R*TC);
T2=TH; %temperatura incial del foco finito
nCiclos=60; %segundo ciclo
for k=1:nCiclos
%1--->2 adibático
v2=v1*(T2/TC)^(1/(1-gamma));
p2=nMoles*R*T2/v2;
%2--->3 politrópico
T3=T2*(v3/v2)^(1-beta);
p3=nMoles*R*T3/v3;
%3--->4 adiabática
v4=v3*(TC/T3)^(1/(1-gamma));
p4=nMoles*R*TC/v4;
%4--->1 isoterma
if k==nCiclos
break;
end
T2=T3; % temperatura final del foco finito caliente
end
%trabajo
cV=3*R/2; %calor específico,
Cr=nMoles*cV*(beta-gamma)/(1-beta); %capacidad calorífica del foco finito
W_12=-nMoles*cV*(T2-TC); %adiabático
W_23=(nMoles*cV+Cr)*(T2-T3); %politrópico
Q_23=Cr*(T2-T3);
W_34=-nMoles*cV*(TC-T3); %adiabático
W_41=nMoles*R*TC*log(v1/v4); %isotermo
Q_41=W_41;
disp('Trabajo');
fprintf('W_12=%2.2f, W_23=%2.2f, W_34=%2.2f, W_41=%2.2f\n', W_12, W_23, W_34, W_41)
disp('Calor');
fprintf('Q_23=%2.2f, Q_41=%2.2f\n', Q_23, Q_41)
disp('Total')
W=W_12+W_23+W_34+W_41;
Q=Q_23+Q_41;
fprintf('Trabajo=%2.2f, Calor =%2.2f\n', W, Q);
%gráfica del ciclo
hold on
fplot(@(v) v, @(v) (p1*(v1./v).^gamma)/1000 ,sort([v2,v1]))
fplot(@(v) v, @(v) (p2*(v2./v).^beta)/1000 ,[v2,v3],'color','r','lineWidth',1.5)
fplot(@(v) v, @(v) (p3*(v3./v).^gamma)/1000 ,sort([v3,v4]))
fplot(@(v) v, @(v) (p4*v4./v)/1000 ,[v1,v4],'color','b','lineWidth',1.5)
plot(v1,p1/1000,'ro','markersize',3,'markerfacecolor','r')
text(v1+0.02,p1/1000,num2str(TC))
plot(v2,p2/1000,'ro','markersize',3,'markerfacecolor','r')
text(v2+0.02,p2/1000,num2str(T2))
plot(v3,p3/1000,'ro','markersize',3,'markerfacecolor','r')
text(v3+0.02,p3/1000,num2str(T3))
plot(v4,p4/1000,'ro','markersize',3,'markerfacecolor','r')
text(v4+0.02,p4/1000,num2str(TC))
hold off
grid on
xlabel('V(m^3)')
ylabel('p(kPa)')
title('Ciclo de Carnot')
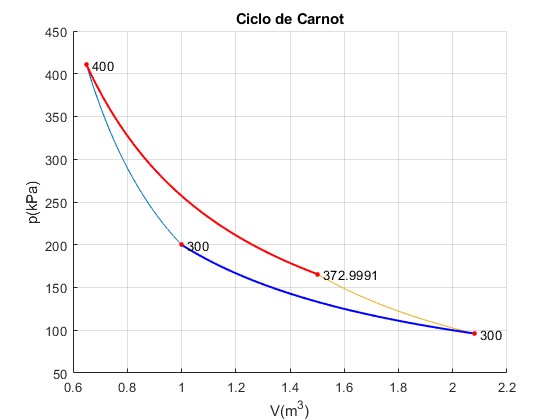
Trabajo W_12=-100000.00, W_23=215575.98, W_34=72999.11, W_41=-146431.09 Calor Q_23=188575.08, Q_41=-146431.09 Total Trabajo=42144.00, Calor =42144.00
Ciclo n° 2
En el segundo ciclo, la temperatura inicial T2 del foco finito caliente es la final de dicho foco T3=373 K en el primer ciclo. En el código, asignamos
Transformación 1-->2, adiabática
Transformación 2-->3, politrópica
Transformación 3-->4, adiabática
Transformación 4-->1, isotérmica a la temperatura TC
Calculamos el trabajo, calor
Transformación 1-->2, adiabática
Transformación 2-->3, politrópica
Transformación 3-->4, adiabática
Transformación 4-->1, isotérmica a la temperatura TC
Q12=0
W12=-n·cv(T2-TC)=-73.00 kJ
Q34=0
W34=-n·cv(TC-T3)=50.88 kJ
Trabajo total, W=W12+W23+W34+W41=26.40 kJ
Calor total, Q=Q23+Q41=26.40 kJ
En un ciclo cerrado la variación de energía interna ΔU=0, por tanto Q=W
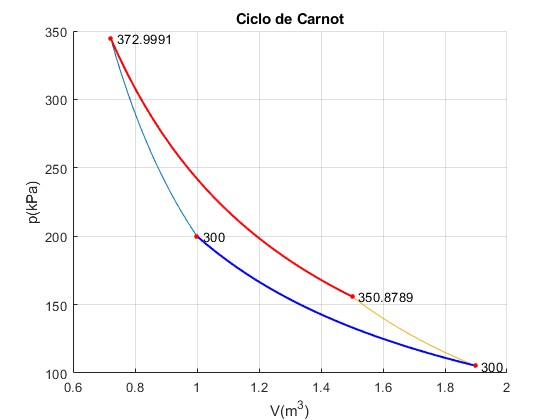
Trabajo W_12=-72999.11, W_23=176608.73, W_34=50878.87, W_41=-128090.59 Calor Q_23=154488.49, Q_41=-128090.59 Total Trabajo=26397.89, Calor =26397.89
Ciclo n° 3
En el tercer ciclo, la temperatura inicial T2 del foco finito caliente es la final T3=350.88 K del segundo ciclo. En el código, cambiamos la sentencia en el script anterior
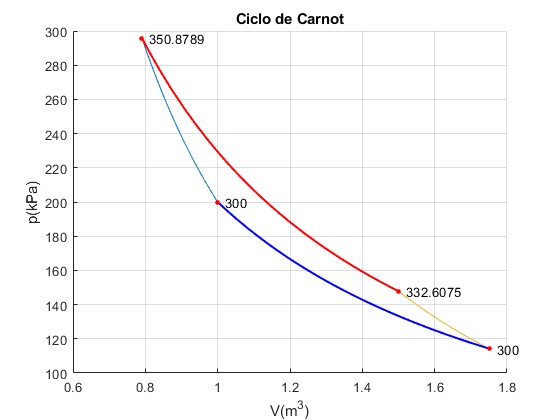
La temperatura del foco caliente finito se va reduciendo a T3=332.6 K
Trabajo W_12=-50878.87, W_23=145878.87, W_34=32607.54, W_41=-112047.25 Calor Q_23=127607.54, Q_41=-112047.25 Total Trabajo=15560.29, Calor =15560.29
El trabajo total se va reduciendo, como lo hace el área encerrada por el ciclo
Ciclo n° 6
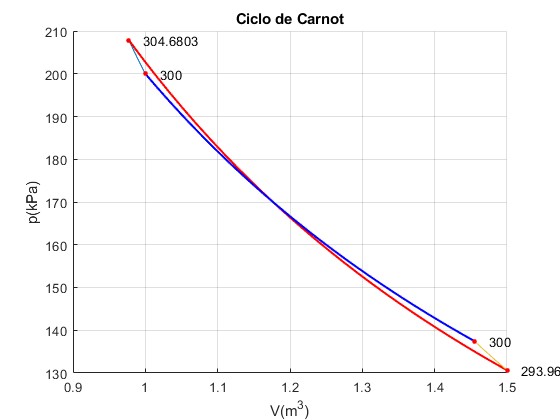
La temperatura inicial del foco finito caliente es T2=304.7 K, al final se ha reducido a T3=294 K por debajo de la temperatura del foco frío TC=300 K. En la transformación 3-->4 el gas se comprime (trabajo negativo) en vez de expandirse. El trabajo total es casi nulo W=0.18 kJ.
Trabajo W_12=-4680.27, W_23=85534.74, W_34=-6032.95, W_41=-74998.58 Calor Q_23=74821.51, Q_41=-74998.58 Total Trabajo=-177.07, Calor =-177.07
Ciclo n° 10
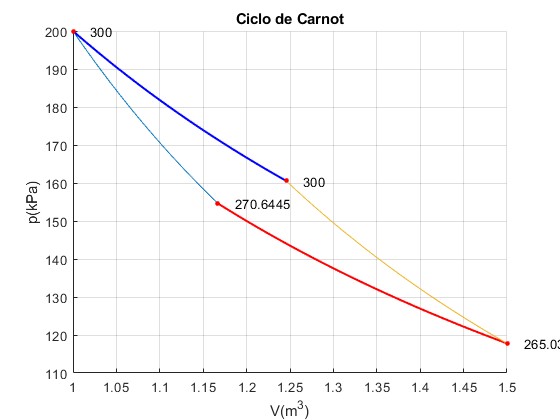
Trabajo W_12=29355.49, W_23=44816.68, W_34=-34968.78, W_41=-43912.57 Calor Q_23=39203.39, Q_41=-43912.57 Total Trabajo=-4709.17, Calor =-4709.17
El dispositivo continúa funcionado como un figorífico, que toma calor del foco finito (ahora es el foco frío) durante la transformación politrópica 2-->3 (línea de color rojo) y lo cede al foco más caliente a la temperatura TC durante la trsnformación isoterma 4--->1 (línea de color azul)
Ciclo n° 20
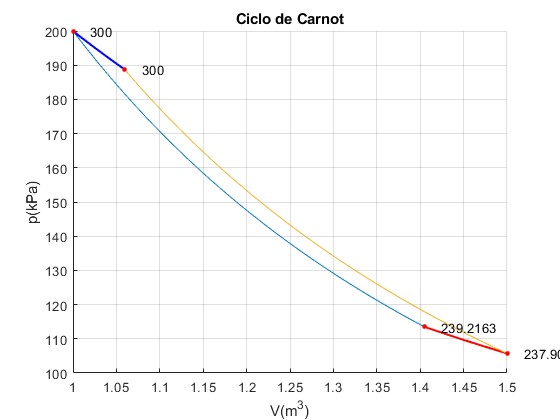
Trabajo W_12=60783.69, W_23=10471.78, W_34=-62095.28, W_41=-11519.36 Calor Q_23=9160.19, Q_41=-11519.36 Total Trabajo=-2359.17, Calor =-2359.17
La temperatura del foco finito continúa decreciendo por debajo del foco frío TC ya que se transfiere calor al gas desde el foco finito, cuando se expande
Ciclo n° 30
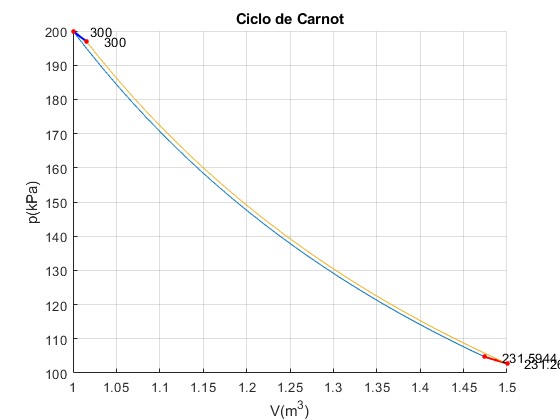
Trabajo W_12=68405.65, W_23=2664.88, W_34=-68739.42, W_41=-3021.82 Calor Q_23=2331.10, Q_41=-3021.82 Total Trabajo=-690.71, Calor =-690.71
La transformación 2--->3 politrópica y la transformación 4--->1 se hacen cada vez más cortas. El trabajo neto, el área encerrda por el ciclo es cada vez más pequeña
Ciclo n° 60
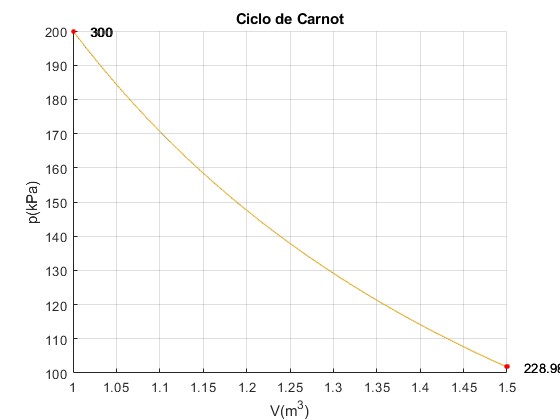
Trabajo W_12=71009.56, W_23=47.60, W_34=-71015.52, W_41=-54.55 Calor Q_23=41.64, Q_41=-54.55 Total Trabajo=-12.91, Calor =-12.91
La transformación 2--->3 politrópica y la transformación 4--->1 han casi desaparecido, el émbolo se mueve hacia adelante y hacia atrás a través de una transformación adiabática que no genera trabajo neto, el área encerrada por el ciclo es cero. No se extrae calor del foco finito, su temperatura límite Tf=228.9 no cambia
Temperatura inicial y final del foco finito
Transformación 1-->2, adiabática
Transformación 2-->3, politrópica
Relacionamos las temperaturas T3 final del foco finito, y T2 inicial del foco finito con los volúmenes fijos V1 y V3 y la temperatura TC del foco frío
Ciclo n° 1
Ciclo n° 2
Ciclo n° 3
Ciclo n° k
TH0=400 K es la tmperatura inicial del foco caliente
El exponente es la suma de n=k-2 términos de una progresión geométrica cuyo a0=1 y la razón r=b. Como 1<β<γ resulta b<1, y por tanto, la serie es convergente
Las temperaturas valen
Para el ciclo n° 10, la temperatura inicial del foco finito es T2=270.6445 K y la temperatura final T3=265.0312 K, tal como podemos ver en la figura correspondiente al ciclo n° 10
gamma=5/3; % adibático, beta=1.0835; %politrópico v1=1; v3=1.5; Tc=300; TH=400; b=(gamma-beta)/(gamma-1); a=(1/1.5)^(beta-1)*TC^((beta-1)/(gamma-1)); k=10; %ciclo T2=a^((1-b^(k-1))/(1-b))*TH^(b^(k-1)); %inicial T3=a^((1-b^k)/(1-b))*TH^(b^k); %final disp([T2, T3])
270.6445 265.0312
Representamos la temperatura inicial T2 (punto de color rojo) y final T3 (punto de color azul) del foco finito en función de el número de ciclo k
gamma=5/3; % adibático,
beta=1.0835; %politrópico
v1=1; v3=1.5; Tc=300; TH=400;
b=(gamma-beta)/(gamma-1);
a=(v1/v3)^(beta-1)*TC^((beta-1)/(gamma-1));
g=@(k) (a.^((1-b.^(k-1))/(1-b))).*(TH.^(b.^(k-1))); %temperatura inicial
f=@(k) (a.^((1-b.^k)/(1-b))).*(TH.^(b.^k)); %temperatura final
kk=1:60;
hold on
line([0,60],[TH,TH],'color','r')
line([0,60],[TC,TC],'color','b')
%hold on
plot(kk, g(kk),'ro','markersize',3,'markerfacecolor','r')
plot(kk, f(kk),'bo','markersize',3,'markerfacecolor','b')
hold off
ylim([220,410])
grid on
legend('inicial','final','location','best')
xlabel('k')
ylabel('T_2, T_3')
title('Temperaturas del foco')
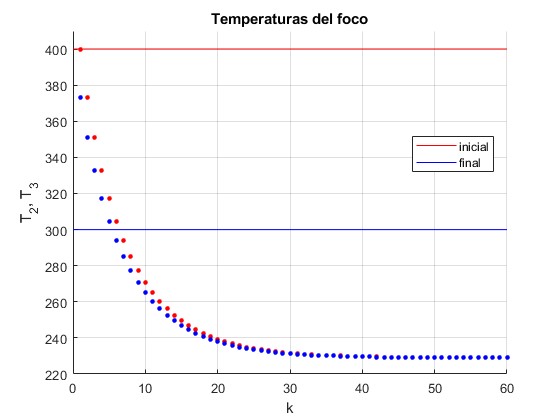
Cuando k se hace grande ambas temperaturas tienden hacia un valor límite Tf
Como b<1, bk tiende a cero cuando k→∞
Con V1=1 m3, V2=1.5 m3 y TC=300 K, la temperatura final es Tf=228.9428 K tal como puede verse en la figura correspondiente al ciclo n° 60
Como V1<V3, Tf<TC. El foco finito inicialmente caliente (TH= 400 K) termina siendo más frío (Tf=228.9 K) que el foco frío (TC=300 K)
Trabajo y rendimiento
El trabajo se produce en las cuatro transformaciones del ciclo cerrado
El calor se produce en la transformación 2--->3 politrópica en contacto con el foco finito y en la 4--->1 isoterma en contacto con el foco frío
En un ciclo cerrado la variación de energía interna ΔU=0 por lo que el trabajo W y el calor Q son iguales, tal como se ha comprobado en la sección Ciclo de Carnot con el foco caliente de capacidad calorífica finita
En la transformación 3-->4, adiabática se cumple
Calculamos Q23 y Q41 para cada ciclo k
gamma=5/3; % adibático,
beta=1.0835; %politrópico
p1=200e3; v1=1; v3=1.5; TC=300; TH=400;
R=8.3143; %constante de los gases
nMoles=p1*v1/(R*TC);
cV=3*R/2; %calor específico,
Cr=nMoles*cV*(beta-gamma)/(1-beta); %capacidad calorífica del foco finito
b=(gamma-beta)/(gamma-1);
a=(1/1.5)^(beta-1)*TC^((beta-1)/(gamma-1));
k=6; %ciclo
T2=a^((1-b^(k-1))/(1-b))*TH^(b^(k-1)); %inicial
T3=a^((1-b^k)/(1-b))*TH^(b^k); %final
Q_23=Cr*(T2-T3);
Q_41=nMoles*R*TC*log(v1*(TC/T3)^(1/(gamma-1))/v3);
fprintf('Trabajo=%2.2f, Calor absorbido=%2.2f\n', Q_23+Q_41, Q_23);
Trabajo=-177.07, Calor absorbido=74821.51
Para k=6 el trabajo es W=-177.07 J coincide con el valor obtenido para el ciclo n° 6
Representamos el rendimiento η en función del n° de ciclo k
gamma=5/3; % adibático,
beta=1.0835; %politrópico
p1=200e3; v1=1; v3=1.5; TC=300; TH=400;
R=8.3143; %constante de los gases
nMoles=p1*v1/(R*TC);
cV=3*R/2; %calor específico,
Cr=nMoles*cV*(beta-gamma)/(1-beta); %capacidad calorífica del foco finito
b=(gamma-beta)/(gamma-1);
a=(1/1.5)^(beta-1)*TC^((beta-1)/(gamma-1));
k=2; %ciclo
g=@(k) (a.^((1-b.^(k-1))/(1-b))).*(TH.^(b.^(k-1))); %temperatura inicial
f=@(k) (a.^((1-b.^k)/(1-b))).*(TH.^(b.^k)); %temperatura final
kk=1:60;
T2=a^((1-b^(k-1))/(1-b))*TH^(b^(k-1)); %inicial
T3=a^((1-b^k)/(1-b))*TH^(b^k); %final
Q_23=Cr*(g(kk)-f(kk));
Q_41=nMoles*R*TC*log(v1*(TC./f(kk)).^(1/(gamma-1))/v3);
W=Q_23+Q_41;
eta=W./Q_23;
plot(kk, eta,'ro','markersize',3,'markerfacecolor','r')
grid on
xlabel('k')
ylabel('\eta')
title('Rendimiento')
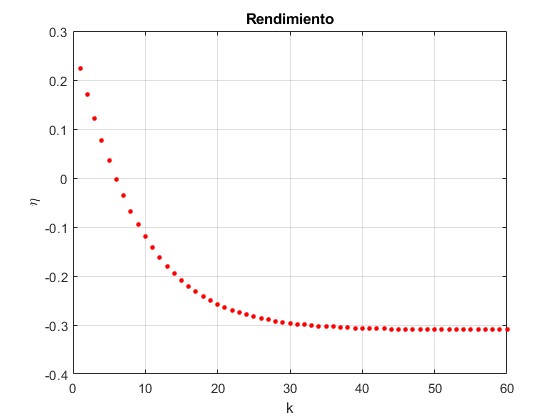
Cuando k>5, la máquina térmica se convierte en frigorífico, la medida relevante es el coeficiente K=-1/η que tiende al valor límite K∞=3.22
Referencias
Yu-Han Ma. Simple realization of the polytropic process with a finite-sized reservoir. Am. J. Phys. 91 (7), July 2023. pp. 555-558
Randall D.Knight. Heat engines with finite reservoirs. Am. J. Phys. 92 (10), October 2024. pp. 759-764

