El ciclo de Carnot
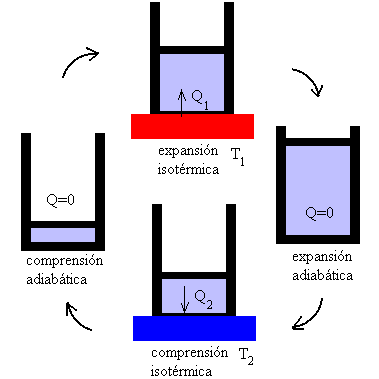
Gas ideal
La representación gráfica del ciclo de Carnot en un diagrama p-V es el siguiente
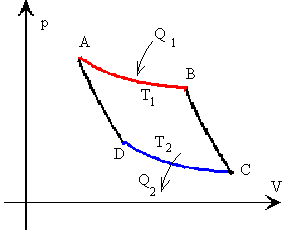
- Tramo A-B isoterma a la temperatura T1
- Tramo B-C adiabática
- Tramo C-D isoterma a la temperatura T2
- Tramo D-A adiabática
En cualquier ciclo, tenemos que obtener a partir de los datos iniciales:
- La presión, volumen de cada uno de los vértices.
- El trabajo, el calor y la variación de energía interna en cada una de los procesos.
- El trabajo total, el calor absorbido, el calor cedido y el rendimiento del ciclo.
Los datos iniciales son los que figuran en la tabla adjunta. A partir de estos datos, hemos de rellenar los huecos de la tabla.
| Variables | A | B | C | D |
|---|---|---|---|---|
| Presión p (atm) | pA | |||
| Volumen V (litros) | VA | VB | ||
| Temperatura T (K) | T1 | T1 | T2 | T2 |
Las etapas del ciclo
Para obtener las variables y magnitudes desconocidas emplearemos las fórmulas que figuran en el cuadro-resumen de las transformaciones termodinámicas.
- Transformación A->B (isoterma)
- Transformación B->C (adiabática)
- Transformación C->D (isoterma)
- Transformación D-> A (adiabática)
La presión pB se calcula a partir de la ecuación del gas ideal
Variación de energía interna
Trabajo
Calor
La ecuación de estado adiabática es o bien, . Se despeja Vc de la ecuación de la adiabática . Conocido Vc y T2 se obtiene pc, a partir de la ecuación del gas ideal, .
Calor
Variación de energía interna
Trabajo
Variación de energía interna
Trabajo
Calor
Se despeja VD de la ecuación de la adiabática . Conocido VD y T2 se obtiene pD, a partir de la ecuación del gas ideal, .
Calor
Variación de energía interna
Trabajo
A partir de las ecuaciones de las dos adiabáticas, probamos que la relación entre los volúmenes de los vértices es
El ciclo completo
- Variación de energía interna
- Trabajo
- Calor
- Rendimiento del ciclo
En un proceso cíclico reversible la variación de energía interna es cero
En la isoterma T1 se absorbe calor Q>0 ya que VB>VA de modo que
En la isoterma T2 se cede calor Q<0 ya que VD<VC
Se define rendimiento como el cociente entre el trabajo realizado y el calor absorbido
Ejemplo
Un gas monoatómico, cv=3R/2, describe el ciclo de Carnot de la figura. Las transformaciones A-B y C-D son isotermas a la temperatura T1=450 K y T2=293 K. Las transformaciones B-C y D-A son adiabáticas. Se conoce la presión pA=15 atm, el volumen vA=4 l, y el volumen vB=8 l (Véase la figura al final de la página)
- Hallar los valores de la presión, el volumen, y la temperatura de cada uno de los vértices A, B, C y D a partir de los datos suministrados.
- Calcular de forma explícita el trabajo en cada una de las transformaciones, la variación de energía interna y el calor.
- Hallar el rendimiento del ciclo y comprobar que coincide con el valor dado por la fórmula del rendimiento de un ciclo de Carnot.
Dato: R=8.314 J/(K mol)=0.082 atm.l/(K mol)
- Presión y volumen de los cuatro vértices
| Vértice | p(atm) | V(l) | T(K) |
|---|---|---|---|
| A | 15 | 4 | 450 |
| B | 7.5 | 8 | 450 |
| C | 2.57 | 15.23 | 293 |
| D | 5.13 | 7.61 | 293 |
- Trabajo, calor y variación de energía interna en los cuatro procesos
| Proceso | W(atm·l) | Q(atm·l) | ΔU(atm·l) |
|---|---|---|---|
| A→B | 41.59 | 41.59 | 0 |
| B→C | 31.40 | 0 | -31.40 |
| C→D | -27.08 | -27.08 | 0 |
| D→A | -31.40 | 0 | 31.40 |
| Ciclo | 14.51 | 0 |
- Ciclo completo
Trabajo total: W=14.51 atm·l
Calor absorbido: Qabs=41.59 atm·l
Calor cedido: Qced=27.08 atm·l
Rendimiento
Elaboramos un script para calcular la presión, volumen y temperatura de los cuatro vértices cuando se conoce:
- La temperatura T1 de la isoterma que pasa por A y B
- La temperatura T2 de la isoterma que pasa por C y D (T2<T1)
- La presión pA y el volumen vA
- El volumen vB (vB>vA)
- Si el gas ideal es monoatómico o diatómico
El programa, calcula el trabajo y calor en cada etapa del ciclo.
El trabajo total, el calor absorbido, el calor cedido y el redimiento del ciclo
La representación gráfica del ciclo
Este script puede servir de modelo para resolver cualquier otro ciclo
%datos
T1=450; % Temperatura de la isoterma A y B
T2=293; %temperatura de la isoterma C y D
vA=4;
vB=8;
pA=15;
R=0.082; %constante de los gases (atm·l)/(K·mol)
%gas monoatómico
gamma=5/3; % 7/5 para el diatómico
cV=3*R/2; %calor específico, 5*R/2 para el diatómico
%resultados
nMoles=pA*vA/(R*T1);
disp('Vértices');
pB=pA*vA/vB;
vC=(T1*vB^(gamma-1)/T2)^(1/(gamma-1));
pC=nMoles*R*T2/vC;
vD=(T1*vA^(gamma-1)/T2)^(1/(gamma-1));
pD=nMoles*R*T2/vD;
fprintf('Vertice A: pA=%2.2f, vA=%2.2f, TA=%2.2f\n', pA, vA, T1)
fprintf('Vertice B: pB=%2.2f, vB=%2.2f, TB=%2.2f\n', pB, vB, T1)
fprintf('Vertice C: pC=%2.2f, vC=%2.2f, TC=%2.2f\n', pC, vC, T2)
fprintf('Vertice D: pD=%2.2f, vD=%2.2f, TD=%2.2f\n', pD, vD, T2)
disp('Trabajo');
W_AB=nMoles*R*T1*log(vB/vA);
W_BC=nMoles*cV*(T1-T2);
W_CD=nMoles*R*T2*log(vD/vC);
W_DA=nMoles*cV*(T2-T1);
fprintf('W_AB=%2.2f, W_BC=%2.2f, W_CD=%2.2f, W_DA=%2.2f\n',
W_AB, W_BC, W_CD, W_DA)
disp('Calor');
Q_AB=W_AB;
Q_BC=0;
Q_CD=W_CD;
Q_DA=0;
fprintf('Q_AB=%2.2f, Q_BC=%2.2f, Q_CD=%2.2f, Q_DA=%2.2f\n'
, Q_AB, Q_BC, Q_CD, Q_DA)
disp('Total')
W=W_AB+W_BC+W_CD+W_DA;
Q=Q_AB+Q_BC+Q_CD+Q_DA;
fprintf('Trabajo=%2.2f, Calor absorbido=%2.2f, Calor cedido=%2.2f,
rendimiento=%1.2f\n', W, Q_AB, Q_CD, W/Q_AB);
rendimiento=1-T2/T1;
disp(rendimiento)
%gráfica del ciclo
hold on
fplot(@(v) v,@(v) (nMoles*R*T1)./v, [vA,vB], 'r')
fplot(@(v) v,@(v) (pB*vB^gamma)./v.^gamma,[vB,vC], 'k')
fplot(@(v) v,@(v) (nMoles*R*T2)./v, [vD,vC],'b')
fplot(@(v) v,@(v) (pA*vA^gamma)./v.^gamma,[vA,vD],'k')
xlim([0,vC+1])
ylim([0,pA+1])
hold off
grid on
xlabel('v(l)')
ylabel('p(atm)')
title('Ciclo de Carnot')
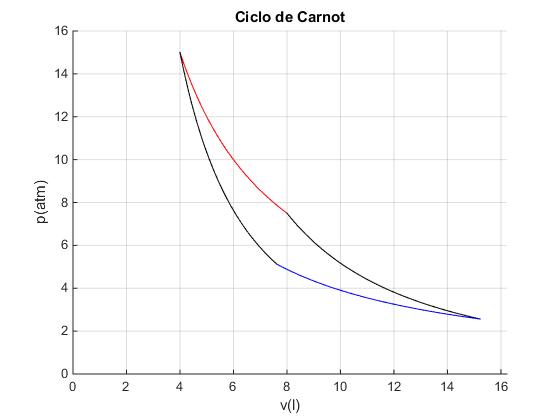
Vértices Vertice A: pA=15.00, vA=4.00, TA=450.00 Vertice B: pB=7.50, vB=8.00, TB=450.00 Vertice C: pC=2.57, vC=15.23, TC=293.00 Vertice D: pD=5.13, vD=7.61, TD=293.00 Trabajo W_AB=41.59, W_BC=31.40, W_CD=-27.08, W_DA=-31.40 Calor Q_AB=41.59, Q_BC=0.00, Q_CD=-27.08, Q_DA=0.00 Total Trabajo=14.51, Calor absorbido=41.59, Calor cedido=-27.08, rendimiento=0.35 rendimiento = 0.3489
Gas de van der Waals
La ecuación de van der Waals tiene en cuenta el volumen finito de las moléculas y las fuerzas atractivas que una molécula ejerce sobre otra a distancias muy cercanas entre ellas.
Las constantes a y b son característicos de cada gas y se obtienen a partir de los datos de la presión Pc, volumen Vc y la temperatura Tc crítica.
Transformación adiabática
La entropía de una sustancia es una función de dos variables, la temperatura T y el volumen V. La tercera variable p está relacionada con las otras dos V y T por la ecuación de estado
Hemos multiplicado ambos miembros por la temperatura T
Teniendo en cuenta δQ=T·dS, y δQ=ncvdT, en una transformación a volumen constante
donde cv es el calor específico a volumen constante.
Teniendo en cuenta la tercera relación de Maxwell
obtenemos
En una transformación adiabática, δQ=T·dS=0
Para el gas de van der Waals
Obtenemos
Separamos variables e integramos
Despejamos la temperatura T en la ecuación de van der Waals y la introducimos en esta última ecuación
El índice Γ es distinto de γ=cp/cv de un proceso adiabático con gas ideal. C es una constante
Calor específico a volumen connstante cv
Aplicamos el primer pricipio de la Termodinámica
Para que dU sea diferencial exacta, se tiene que cumplir que
En nuestro caso
Lo que indica que el calor específico cv no depende del volumen V, solamente de la temperatura T.
Calor
Partiendo de la ecuación
Para el gas de van der Waals
Si la temperatura es constante
Trabajo y calor en las cuatro transformaciones
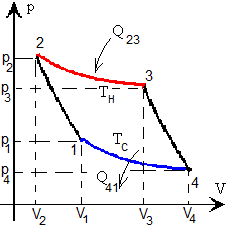
Transformación 1--->2, el gas se comprime adiabáticamente entre V1 y V2
Transformación 2--->3, expansión isoterma a temperatura TH entre V2 y V3
Transformación 3--->4, expansión adiabática entre V3 y V4
Transformación 4--->1, el gas se comprime isotermicamente a temperatura TC entre V4 y V1
Por ser transformación adiabática se cumple
El trabajo W12 es
El calor Q12=0
La primera integral solamente depende de T
El calor Q34=0
Ciclo completo
-
Trabajo, W=W12+W23+W34+W41
Calor absorbido en la expansión isotérmica a la temperatura TH
Calor cedido cuando el gas se comprime isotérmicamente a la temperatura TC
El rendimiento del ciclo es
Teniendo en cuenta las relaciones obtenidas en las transformaciones adiabáticas
Obtenemos la misma expresión del redimiento del ciclo de Carnot η que para un gas ideal
Referencias
D C Agrawal, V J Menon. The Carnot cycle with the van der Waals equation of state. Eur. J. Phys 11, (1990). pp. 88 - 90
Kiran S. Kumar, Aravind P. Babu, M. Ponmurugan. Van der Waal’s gas equation for an adiabatic process and its Carnot engine efficiency. Physics Education. Jul-Sep 2017

