Un ciclo térmico poco habitual (Sadly Cannot)
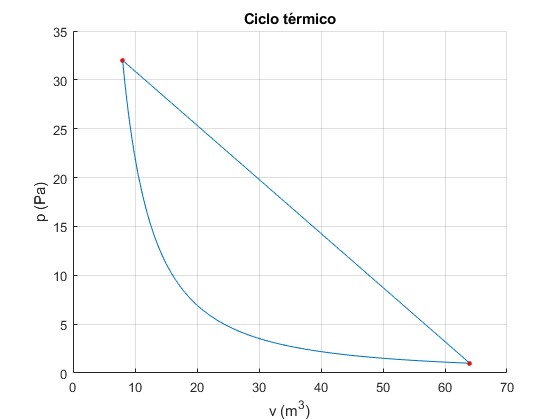
Estudiamos en esta página, un ciclo térmico poco habitual denominado 'Sadly cannot' que consta de dos procesos: una expansión lineal desde el estado (p1, V1, T1) al estado (p2, V2, T2) seguida una compresión adiabática desde el estado 2 al 1.
Representamos gráficamente el ciclo, con los siguientes datos, p1=32 Pa, V1=8 m3, V2=64 m3. Para un gas monoatómico, γ=5/3.
Obtenemos la presión p2 por medio de la ecuación de la adiabática
p2=32·(8/64)5/3=1
p1=32;
V1=8;
V2=64;
gamma=5/3; %monoatómico
p2=p1*(V1/V2)^gamma;
hold on
fplot(@(x) p1*V1^gamma./x.^gamma,[V1,V2])
plot(V1,p1,'ro','markersize',3,'markerfacecolor','r')
plot(V2,p2,'ro','markersize',3,'markerfacecolor','r')
line([V1,V2],[p1,p2])
hold off
grid on
xlabel('v (m^3)')
ylabel('p (Pa)')
title('Ciclo térmico')
La ecuación del proceso lineal es p=aV+b, despejamos la pendiente a y la ordenada en el origen b en el sistema de dos ecuaciones
Análisis habitual, erróneo
Proceso lineal, 1→2
Proceso adiabático, 2→1
Trabajo
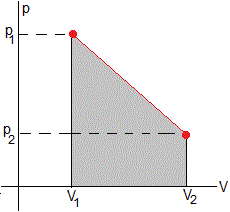
El trabajo es el área sombreada de color gris claro
La variación de energía interna es
Aplicando el primer principio obtenemos el calor
El trabajo en un proceso adiabático es
La variación de energía interna
En un proceso adiabático no hay intercambio de calor
El trabajo neto es, W=636 J
El calor absorbido, Qabs=636 J
El rendimiento
Este rendimiento no es posible, por lo que se precisa un estudio más detallado del problema
Análisis detallado
En el proceso lineal 1→2 hay un estado (pm, Vm, Tm), tal que pm=aVm+b para el cual el flujo de calor cambia de sentido. Este punto donde Q=0 es tangente a una adiabática pVγ=cte. La pendiente de la adiabática en (pm, Vm) es a
p1=32;
V1=8;
V2=64;
gamma=5/3; %monoatómico
p2=p1*(V1/V2)^gamma;
hold on
fplot(@(x) p1*V1^gamma./x.^gamma,[V1,V2])
plot(V1,p1,'ro','markersize',3,'markerfacecolor','r')
plot(V2,p2,'ro','markersize',3,'markerfacecolor','r')
line([V1,V2],[p1,p2])
a=(p2-p1)/(V2-V1);
b=(p1*V2-p2*V1)/(V2-V1);
Vm=-gamma*b/(a*(1+gamma));
pm=b/(1+gamma);
fplot(@(x) pm*Vm^gamma./x.^gamma,[30,60])
plot(Vm,pm,'bo','markersize',3,'markerfacecolor','b')
hold off
grid on
xlabel('v (m^3)')
ylabel('p (Pa)')
title('Ciclo térmico')
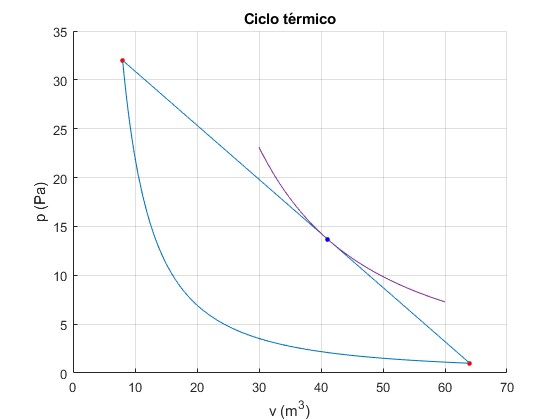
Conocidos a y b despejamos pm y Vm.
Subproceso 1→m
Subproceso m→2
Variación de energía interna
Trabajo
Aplicando el primer principio obtenemos el calor absorbido
Variación de energía interna
Trabajo
Aplicando el primer principio obtenemos el calor cedido
Proceso lineal 1→2
Variación de energía interna
Trabajo
El calor
Q1-2 no es el calor absorbido, sino Q1-m
Ciclo completo
Trabajo neto W=636 J
Calor absorbido, Qabs=1215.1 J
Rendimiento
Temperatura máxima
En el proceso lineal 1→2 hay un estado (ph, Vh, Th), tal que ph=aVh+b para el cual, la temperatura es máxima. Este punto es tangente a una isoterma pV=cte. La pendiente de la isoterma en (ph, Vh) es a
Conocidos a y b despejamos ph y Vh.
p1=32;
V1=8;
V2=64;
gamma=5/3; %monoatómico
p2=p1*(V1/V2)^gamma;
hold on
fplot(@(x) p1*V1^gamma./x.^gamma,[V1,V2])
plot(V1,p1,'ro','markersize',3,'markerfacecolor','r')
plot(V2,p2,'ro','markersize',3,'markerfacecolor','r')
line([V1,V2],[p1,p2])
a=(p2-p1)/(V2-V1);
b=(p1*V2-p2*V1)/(V2-V1);
ph=b/2;
Vh=-b/(2*a);
fplot(@(x) ph*Vh./x,[20,60])
plot(Vh,ph,'bo','markersize',3,'markerfacecolor','b')
hold off
grid on
xlabel('v (m^3)')
ylabel('p (Pa)')
title('Ciclo térmico')
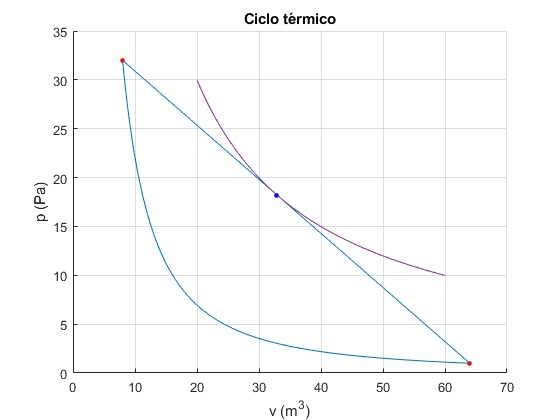
Otra forma de obtener el estado (ph, Vh, Th), es la siguiente
La temperatura de cada uno de los estados a lo largo del proceso lineal 1→2 es
La temperatrura máxima Th es el extremo
Un ciclo de Carnot que operase entre dos focos uno a la temperatura T2 y otro a la temperatura Th, su rendimiento sería
Trabajo, calor absorbido y rendimiento del ciclo
En este apartado expresamos el trabajo, el calor absorbido y el rendimiento de ciclo en función del cociente entre volúmenes, r=V2/V1.
En el proceso lineal, p=aV+b
El trabajo neto es la suma de dos contribuciones, el trabajo en el proceso lineal y en el proceso adiabático
Para un gas monoatómico γ=5/3
En el proceso lineal 1→2 hay un estado (pm, Vm, Tm), tal que pm=aVm+b para el cual el flujo de calor cambia de sentido. Este punto donde Q=0 es tangente a una adiabática pVγ=cte. La pendiente de la adiabática en (pm, Vm) es a
Los resultados que obtuvimos en el apartado anterior
Para un gas monoatómico γ=5/3
El calor absorbido es la suma de la variación de energía interna y del trabajo en el subproceso lineal 1→m
Para un gas monoatómico γ=5/3
El rendimiento es
Cuando r=V2/V1 se hace muy grande, el rendimiento η tiende a
>> syms r; >> y=-16*(r^(-5/3)-1)*(r-1)*(r+4*r^(-2/3)-r^(-5/3)-4)/(9*(r^(-5/3)-1)^2+ 30*(r^(-5/3)-1)*(r-1)+25*(r-1)^2); >> limit(y,r,inf) ans =16/25
Representamos el rendimiento η en función de r=V2/V1, a partir del valor de r en el que el cociente W/Qabs se hace positivo
Obtenemos este valor inicial de r, utilizando la función
p1=32;
V1=8;
V2=64;
W=@(r) p1*V1*(r+4*r.^(-2/3)-r.^(-5/3)-4)/2;
alfa=@(r) (r.^(-5/3)-1)./(r-1);
Q=@(r)-p1*V1*(9*alfa(r).^2+30*alfa(r)+25)./(32*alfa(r));
f=@(r) W(r)./Q(r);
rIni=fzero(f,[0.1,5]);
fplot(f,[rIni,25])
r=V2/V1;
rendimiento=f(r);
line([r,r],[0,rendimiento], 'lineStyle','--')
line([0,r],[rendimiento,rendimiento], 'lineStyle','--')
grid on
xlabel('r')
ylabel('\eta')
title('Rendimiento')
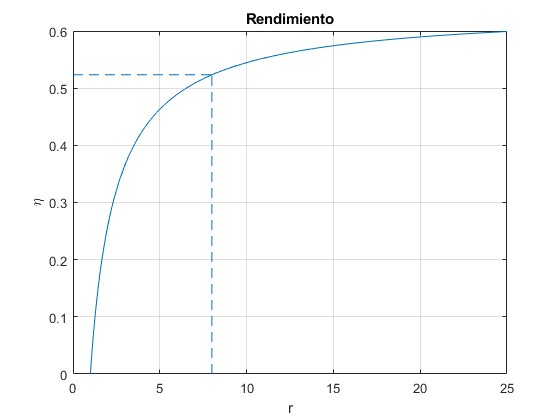
En la gráfica, señalamos el valor de r=V2/V1=64/8=8, del ciclo estudiado en el primer apartado, el rendimiento obtenido, η=0.52
Referencias
J. Willis, D. F. Kirwan. The ‘Sadly Cannot’ thermodynamic cycle. Phys. Teach. 18, pp. 51–52 (1980)
D. S. Mills, C. S. Huston, The ‘Sadly Cannot’ thermodynamic cycle revisited, Phys. Teach. 29, pp. 180–181 (1991).
Bruce Cameron Reed. A Deeper Look at the Sadly Cannot Thermodynamic Cycle. the Physics Teacher Vol. 61, May 2023, pp. 331-333

