Proceso politrópico
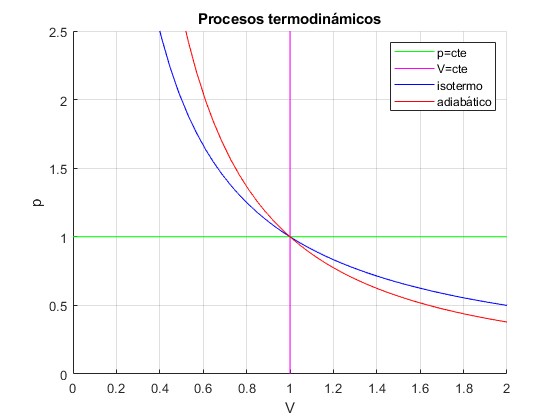
Representamos los cuatro procesos termodinámicos
hold on
line([0,2],[1,1], 'color', 'g')
line([1,1],[0,2.5],'color','m')
fplot(@(V) 1./V,[0.25,2], 'color','b')
fplot(@(V) 1./V.^1.4,[0.25,2], 'color','r')
hold off
grid on
ylim([0,2.5])
xlabel('V')
legend('p=cte','V=cte','isotermo','adiabático')
ylabel ('p')
title('Procesos termodinámicos')
Conocida la relación entre presión y volumen en un proceso politrópico, pVβ=cte, para un gas ideal cuya ecuación de estado es pV=nRT
La relación entre volumen V y temperatura T es
La relación entre presión p y temperatura T es
Representamos procesos politrópicos de índices: 0.2, 0.5, 3, 10, 100, -10, -2, -1, -0.5, 0
hold on
for n=[0.2,0.5,3,10,100, -10,-2,-1,-0.5,0]
fplot(@(V) 1./V.^n,[0.25,2])
end
n=1.4;
fplot(@(V) 1./V.^n,[0.25,2],'color', 'r','lineWidth',1.2)
n=1;
fplot(@(V) 1./V.^n,[0.25,2],'color', 'b','lineWidth',1.2)
hold off
grid on
ylim([0,2.5])
xlabel('V')
ylabel ('p')
title('Procesos politrópicos')
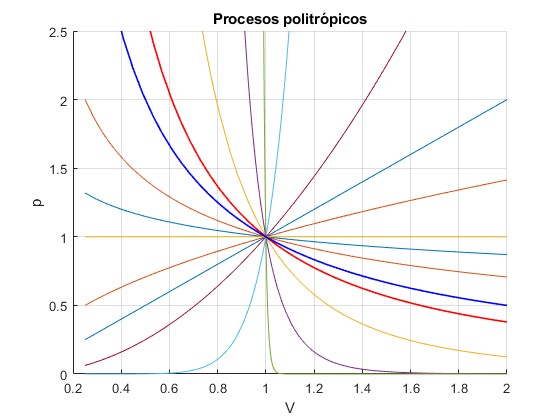
Los procesos con β>0 se representan en los cuadrantes 2° y 4°. Los procesos con β<0 se representan en los cuadrantes 1°y 3°. β=0 es un proceso a presión constante (línea horizontal), y β=100 es un proceso a volumen casi constante (línea vertical)
Las dos líneas más gruesas: la azul, es un proceso con β=1 (isotermo), la roja, es un proceso con β=1.4 (adiabático)
Trabajo
- El estado inicial está caracterizado por una presión p1, un volumen V1 y una temperatura T1
- El estado final está caracterizado por una presión p2, un volumen V2 y una temperatura T2
Se cumple que
El trabajo vale
Otra forma de expresar el trabajo
Teniendo en cuenta la relación entre los calores específicos a presión constante cp y a volumen constante cv
cp=cv+R, γ=cp/cv, cv=R/(γ-1)
Variación de energía interna
La variación de energía interna entre los estados inicial y final es
Calor
El primer principio de la Termodinámica, ΔU=Q-W, Q=ΔU+W
Es la definición de calor específico cβ en un proceso politrópico
Representamos cβ/R en función de β, tomando el índice addibático γ=1.4
gamma=1.4;
f=@(x) (x-gamma)./((gamma-1)*(x-1));
hold on
fplot(f, [-1,3])
plot(0,7/2,'ro','markersize',3,'markerfacecolor','r')
line([-1,0],[7/2,7/2],'lineStyle','--')
line([0,0],[0,7/2],'lineStyle','--')
line([-1,3],[5/2,5/2],'lineStyle','--')
plot(gamma,0,'ro','markersize',3,'markerfacecolor','r')
hold off
grid on
ylim([-2,10])
xlabel('\beta')
ylabel ('c_\beta/R')
title('Calor específico c_\beta')
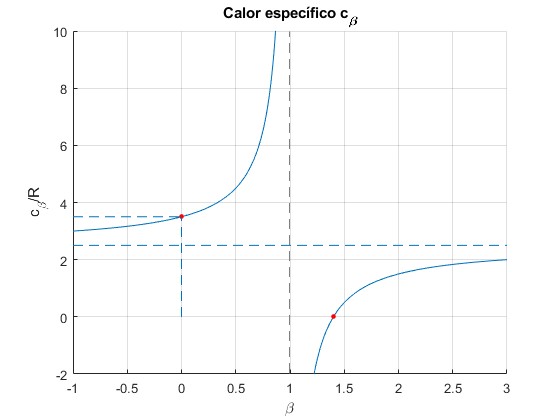
- Para un proceso a presión constante, β=0, cβ=cp=7R/2
- Para un proceso adiabático, β=γ, cβ=0
- Para un proceso isotermo, β=1, cβ→∞
- Para un procso a volumen constante, β→∞, cβ→R/(γ-1)=cv=5R/2. Esta es la ecuación de la asíntota horizontal
El calor específico cβ es negativo en el intervalo (1,γ)
Deducción alternativa de proceso politrópico
Hemos partido de la definición de proceso politrópico como pVβ=cte. Partimos ahora de, dQ=ncβdT y llegamos a pVβ=cte, del siguiente modo
Relación entre trabajo y calor
Relacionamos el calor Q y el trabajo W
Representamos el cociente W/Q en función de β tomando γ=1.4 (aire)
gamma=1.4;
f=@(x) (gamma-1)./(gamma-x);
fplot(f, [-5,5])
line([1,1],[0,f(1)],'lineStyle','--')
line([-5,1],[f(1),f(1)],'lineStyle','--')
line([0,0],[0,f(0)],'lineStyle','--')
line([-5,0],[f(0),f(0)],'lineStyle','--')
grid on
ylim([-2.5,2.5])
xlabel('\beta')
ylabel ('W/Q')
title('Procesos politrópicos')
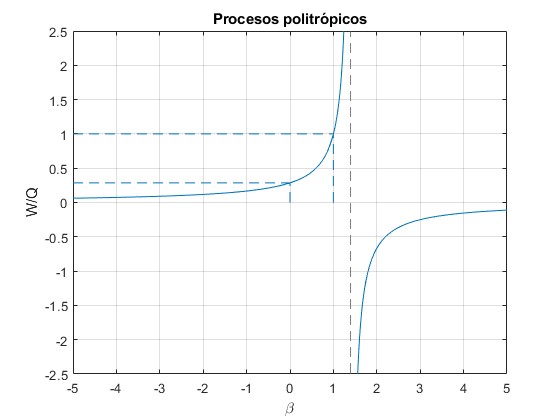
Para un proceso termodinámico caracterizado por un índice β<γ, el resultado es W/Q>0, parte del calor absorbido Q>0 se convierte en trabajo W>0 (el gas se expande). Si el gas se comprime W<0 el gas cede calor Q<0 a los alrededores del sistema.
Adiabático
A presión constante
A temperatura constante
A volumen constante
Cuando β=γ, el denominador se aproxima a cero, esto significa que el calor transferido desde o hacia el sistema tiende a cero.
Para un proceso a presión constante, β=0 y γ=1.4 (para el aire) el cociente es W/Q=0.286, esto quiere decir, que el 28.6% del calor suministrado se convierte en trabajo, el resto se convierte en energía interna. Este resultado es independiente de la presión, volumen o temperatura del estado inicial y final de dicho proceso, solamente depende del tipo de gas.
β=1, el cociente W/Q=1, el calor absorbido se convierte en trabajo, la variación de energía interna es cero, ΔU=0, la temperatura permanece constante
Para un proceso a volumen constante, β→∞, el denominador en la expresión W/Q tiende a -∞, el trabajo tiende a cero
Indice politrópico
Cuando se comprime el aire muy rápidamente, no hay tiempo de que el sistema transfiera calor a los alrededores, el aire incrementa su temperatura, el proceso es adiabático β=γ
Cuando se comprime aire muy lentamente, se transfiere calor a los alrededores, la temperatura del aire permanece constante, el proceso es isotermo, β=1
Un proceso real no será ni infinitamente rápido, ni infinitamente lento, el proceso politrópico tendrá un índice β comprendido entre 1 y γ.
Dados el estado inicial y final, el índice del proceso politrópico se calcula despejando β.
Conocida la presión y el volumen
Conocida la temperatura y el volumen
Conocida la temperatura y la presión
Cuando 1<β<γ el calor específico cβ<0. La idea de calor específico negativo parace algo extraña, ya que la tempartaura del gas ΔT>0 se incrementa a la vez que el gas cede calor Q<0 o viceversa
Procesos isotermo, adiabático y politrópico
Estado inicial del gas
p1=17.5 atm, V1=0.2124 l, T1=2000 K
Estado final
V1=1 l
Representamos los tres procesos: isotermo, adiabático y politrópico entre el estado incial y el estado final. Calculamos la presión p2 y la temperatura T2 del estado final
Calculamos el calor Q, trabajo W y variación de energía interna, ΔU en cada uno de los procesos
gamma=1.4;
beta=1.1689;
p1=17.5; %estado inicial
V1=0.2124;
T1=2000;
V2=1; %estado final
hold on
fplot(@(x) p1*V1^gamma./x.^gamma, [V1,V2])
fplot(@(x) p1*V1^beta./x.^beta, [V1,V2])
fplot(@(x) p1*V1./x, [V1,V2])
hold off
grid on
xlabel('V (l)')
legend('adiabático','politrópico','isotermo','location','best')
ylabel ('p(atm)')
title('Adiabático, isotermo, politrópico')
%isotermo
p2=p1*V1/V2;
T2=2000;
Du=0;
W=p1*V1*log(V2/V1);
Q=W;
fprintf('isotermo: p2=%1.3f, T2=%4.1f, Du=%1.3f, Q=%1.3f, W=%1.3f\n',
p2, T2, Du, Q, W)
%adiabático
p2=p1*V1^gamma/V2^gamma;
T2=T1*V1^(gamma-1)/V2^(gamma-1);
Du=5*p1*V1*(T2-T1)/(2*T1);
Q=0;
W=(p2*V2-p1*V1)/(-gamma+1);
fprintf('adiabático: p2=%1.3f, T2=%4.1f, Du=%1.3f, Q=%1.3f, W=%1.3f\n',
p2, T2, Du, Q, W)
%politrópico
p2=p1*V1^beta/V2^beta;
T2=T1*V1^(beta-1)/V2^(beta-1);
Du=5*p1*V1*(T2-T1)/(2*T1);
Q=p1*V1*(beta-gamma)*(T2-T1)/(T1*(gamma-1)*(beta-1));
W=(p2*V2-p1*V1)/(-beta+1);
fprintf('politrópico: p2=%1.3f, T2=%4.1f, Du=%1.3f, Q=%1.3f, W=%1.3f\n',
p2, T2, Du, Q, W)
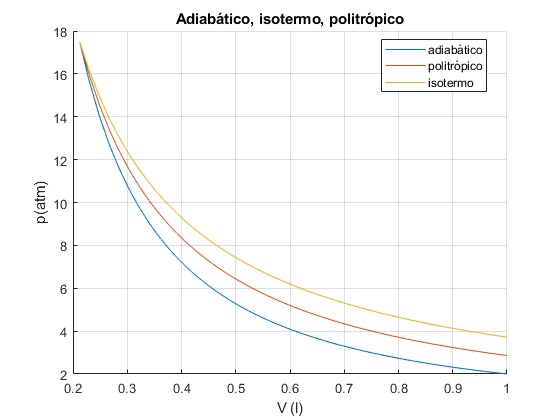
isotermo: p2=3.717, T2=2000.0, Du=0.000, Q=5.759, W=5.759 adiabático: p2=2.000, T2=1076.2, Du=-4.292, Q=0.000, W=4.292 politrópico: p2=2.861, T2=1539.5, Du=-2.139, Q=2.927, W=5.067
Proceso isotermo
Proceso adiabático, γ=1.4 (para el aire)
Proceso politrópico, β=1.1689
El trabajo y el calor
El resultado es p2=3.717 atm, la temperatura T2=2000 K
El resultado es p2=2.0 atm, la temperatura T2=1076.2 K
El trabajo y la varición de energía interna
Se cumple el primer principio de la Termodinámica, ΔU=Q-W
El resultado es p2=2.861 atm, la temperatura T2=1539.5 K
El trabajo, calor y la variación de energía interna
Se cumple el primer principio de la Termodinámica, ΔU=Q-W
Expansión rápida de una mezcla de aire con vapor saturado
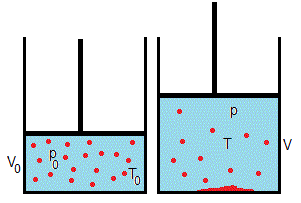
Un recipiente de volumen V0 contiene aire y vapor saturado a la temperatura T0. El émbolo ejerce una presión p0.
El número de moles de vapor saturado es
Donde MH2O=18 g/mol es la masa molecular del agua y R=8.3143 J/(K·mol) es la constante de los gases.
Supondremos que el vapor se comporta como un gas ideal cuya presión parcial Pv0 se puede consultar en las tablas o deducir de fórmulas empíricas de ajuste de los datos experimentales. Por ejemplo, para T0=19 °C (292 K) la presión de vapor saturado es Pv0=2 198 Pa
Cuando el émbolo se desplaza rápidamente. El volumen de aire aumenta a V y la temperatura disminuye de T0 a T=T0-ΔT, con ΔT<<T0
Al disminuir la temperatura de la mezcla, la presión de vapor Pv se reduce, una parte del vapor inicial nv se condensa.
El número de moles de vapor que se ha condensado es la diferencia
El calor generado en la condensación será
Donde L=43 509 J/mol es el valor de la entalpía de vaporización
Como el proceso de expansión es rápido, la mezcla aire-vapor no tiene tiempo de intercambiar calor con el medio ambiente a través de las paredes del recipiente
La presión de vapor viene dada por la fórmula de Clausius-Clapeyron
Sustituimos la presión parcial de vapor Pv en la expresión del calor generado en la condensación
Proceso politrópico
Entre el estado inicial y final se produce un proceso politrópico de índice β que vamos a determinar
El número n de moles de la mezcla (aire+vapor) no permence constante ya que una parte del vapor inicial se condensa. Si esta parte es pequeña, en comparación con el número total de moles, se podría considerar que n es casi constante.
En un proceso politrópico, el calor Q es
Determinación del índice β
Introduciendo V/T, la expresión del calor generado en la condensación es
Dado que las temperaturas inicial y final son próximas, T=T0-ΔT, con ΔT<<T0, desarrollamos en serie tomando el término en ΔT
Utilizamos la función
>> syms x b a; >> y=1-exp(-a*x/(1-x))*(1-x)^(-b/(b-1)); >> taylor(y,x,0,'order',2) ans =x*(a - b/(b - 1))
Comparamos con el calor del proceso politrópico
Despejamos el índice β
Si no hay vapor o la presión es muy pequeña, Pv0≈0, entonces β=γ el proceso es adiabático
Creamos un script para calcular el índice β dada la presión inicial p0 en atmósferas. Datos
- Presión atmosférica, 1.013·105 N/m2
- Temperatura ambiente, T0=19 °C=292 K
- Presión de vapor a esta temperatura, Pv0=2 198 Pa
- Indice adiabático de un gas ideal, γ=1.4
- Constante de los gases, R=8.3143 J/(K·mol)
- Calor de vaporización, L=43 509 J/mol
gamma=1.4; %índice adiabático
L=43509; %calor de vaporización J/mol
T0=292; %temperatura inicial
Pv=2.1983e3;%presión de vapor
R=8.3143; %constante de los gases
for p=[4.8,4.4,4.0,3.6,3.2] %presión en atmósferas
P0=p*1.013e5;
beta=(Pv*L^2*(gamma-1)/(R^2*T0^2*P0)+gamma)/(1+Pv*L*(gamma-1)*
(L/(R*T0)-1)/(R*P0*T0));
disp([p,beta])
end
4.8000 1.2793
4.4000 1.2724
4.0000 1.2647
3.6000 1.2560
3.2000 1.2461
| Presión, p0 (atm) | índice, β |
|---|---|
| 4.8 | 1.2793 |
| 4.4 | 1.2724 |
| 4.0 | 1.2647 |
| 3.6 | 1.2560 |
| 3.2 | 1.2461 |
Son similares a la tercera columna de la tabla I del artículo de Romanelli, pág. 764
Fórmula barométrica
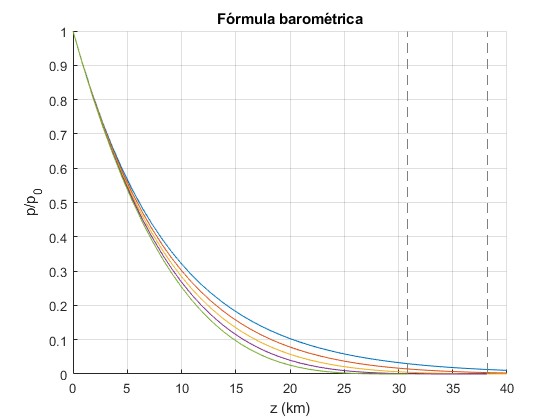
En la página titulada 'Modelos simples de atmósfera', calculamos la variación de la presión del aire en función de la altura por encima del nivel del mar. Suponíamos que la atmósfera está en equilibrio y que su temperatura se mantenía constante, pV=cte.
En este caso, la relación entre presión y volumen responde al la fórmula pVβ=cte
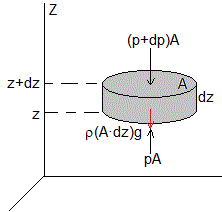
Las fuerzas que actúan sobre el elemento de fluido (aire) de densidad ρ, un cilindro de base A y altura dz
- La que ejerce la presión sobre la cara superior, (p+dp)A
- La que ejerce la presión sobre la cara inferior, (p+dp)A
- El peso, ρ(A·dz)g
Las fuerzas que ejerce la presión sobre la superficie lateral se anulan
En el equilibrio
Supongamos ahora que la relación entre presión y volumen es de la forma
Donde p0 y ρ0 son la presión y densidad a la altura z=0
Integramos la ecuación diferencial
Utilizando la ecuación de estado del un gas ideal
El resultado es
Despejamos la presión
Llamamos
Cuando β→1 (proceso isotermo), x→0, (1+x)1/x→e (número e)
>> syms x; >> limit((1+x)^(1/x),x,0) ans =exp(1)
La variación de presión p con la altura z que obtuvimos para una atmósfera isoterma
Datos
- Masa molecular del aire, M=28.9 g/mol
- Constante de los gases, R=8.3143 J/(K·mol)
- Temperatura para z=0, T0=300 k
R=8.3143; %constante de los gases
T0=300; %temperatura a nivel del mar
M=28.9/1000; %masa molecular del aire en kg/mol
hold on
f=@(z) exp(-M*9.8*1000*z/(R*T0)); %n=1
fplot(f,[0,40])
for n=1.1:0.1:1.4
f=@(z) (1-(n-1)*M*9.8*z*1000/(n*R*T0)).^(n/(n-1));
fplot(f,[0,40])
end
grid on
xlabel('z (km)')
ylabel('p/p_0')
title('Fórmula barométrica')
Referencias
Polytropic process in a closed system. tec-science (07/11/2021)
Alejandro Romanelli, Italo Bove, Federico González Madina. Air expansion in a water rocket. Am. J. Phys. 81 (10), October 2013, pp. 762-766
W EI Guo-zhu,GU Yong-wei,DU An. The improvement on the barometric formula in isothermal process of the gas. College Physics, Volume 25, Issue 11, 20 November 2006

